I. 서 론
교모세포종 또는 다형 교모세포종(Glioblastoma, GBM)은 신경교종 중에서 가장 악성도가 높은 유형이다. World Health Organization(WHO) 중추신경계 종양 분류 기준으로 최고등급인 4등급에 해당한다. 교모세포종의 발병 비율은 2022년도 기준으로 모든 중추신경계 종양의 14.5%, 악성 중추신경계 종양의 48.6%를 차지한다(1). 대한민국의 2021년도 통계청-보건복지부 암 등록 통계에 따르면, 2021년도 기준으로 뇌 및 중추신경계 암 발생률은 인구 10만 명 당 4명으로, 1999부터 발생률이 증가 추세를 보이고 있다(2). GBM은 진행이 빠르고 재발가능성이 매우 높아 예후가 매우 좋지 않으며, 생존율도 현저히 낮다. 생존 중앙값의 경우, 전체 생존 기간 중앙값은 15개월에 불과해 다른 암들과 비교하여도 생존율이 매우 낮은 축에 속한다(1).
대표적인 증상으로는 두통, 뇌 부종, 오심, 종양성 발작, 뇌신경 장애, 시력 저하 또는 상실, 신경쇠약, 마비증세, 인지기능 저하 등이 있다. 현재까지 연구가 진행된 발병 요인으로는 유전자 변이, 방사선 노출 등이 있다. 또한, 뇌실 하 영역에 있는 신경줄기세포의 유전자 변이가 원인일 수 있다는 연구도 나왔으나(3, 4), 아직 정확한 원인은 알려지지 않고 있다. 따라서 암을 미리 예방하는 것은 현실적으로 불가능하며, 주기적인 검진을 통해 조기 진단 및 치료가 필요하다.
교모세포종은 자기공명영상촬영(magnetic resonance imaging, MRI)나 컴퓨터 단층 촬영(computed tomography, CT) 등을 통해 진단이 가능하나, 교모세포종을 치료하는 치료법은 정형화되지 않았다(5-7). 현재 표준적인 치료법으로는 수술로 종양을 최대한 제거하고, 남아있는 종양 세포로 인한 높은 재발과 침윤 가능성을 줄이기 위해 수술 후 방사선치료와 항암제 투여를 병행하는 것이 일반적이다(8). 경우에 따라서 지속적으로 약물이 해당 부위에 효과적으로 전달되도록 하기 위해, 종양을 제거한 부위에 약물이 들어있는 녹는 솜이나 생분해성 웨이퍼를 넣은 후 수술부위를 봉합하기도 한다. 또한, 영상의학적 진단을 통해서 종양의 크기가 너무 크거나 혈관에 인접하여 출혈 등의 위험성으로 인해 수술이 불가능할 경우 또는 종양의 크기가 작아서 약물이나 방사선치료로도 가능할 것으로 보이는 경우, 방사선치료와 항암제 투여 또는 복합치료를 1차적 치료 방법으로 사용하기도 한다.
그 외에도 Tumor Treating Field나 백신, 바이러스, 면역 관문 억제제(Immune checkpoint inhibitor) 등 여러 치료법과 항암제 들이 개발되고 연구되고 있으나, 화학 항암제를 투여하는 치료에는 몇 가지 어려움이 있다.
-
뇌혈관 장벽(blood brain barrier, BBB)과 생체 이용률에 의해 약물들의 선택에 제한이 있다. BBB를 통과하기 위해서는 약물의 분자 크기가 작아야 하며, 일정 비율 이상의 친유성도 가지고 있어야 한다. 또한, BBB는 약물을 외부로 유출시키는 작용도 하고 있다는 것을 고려해야 한다. 직접 종양이 있는 부위에 주사를 하는 것이 가장 좋은 효과를 볼 수 있지만, 두개골이 있어 바늘 진입이 불가능하다. 설령 바늘이 진입하더라도 뇌의 신경 손상과 출혈을 일으킬 위험이 있어 이 방법은 전혀 현실적이지 않다.
-
약물 투여에 성공하더라도, 종양의 이질성과 O6-metylguanine metyltransferase(MGMT) 등으로 인한 약물 내성이 생길 가능성이 있다(9, 10).
-
항암제들이 가지고 있는 여러 가지 심각한 부작용을 동반할 수 있어 환자들에 대한 치료에 부담을 더하고 있다.
따라서 BBB를 통과하기 용이하며, 부작용을 줄일 수 있으면서도 높은 효과와 특이성도 기대할 수 있는 약물과 치료법 개발이 필요한 상황이며 여러 연구자들에 의해 여러 치료법이 개발되어 있다.
여기에서는 교모세포종(glioblastoma multiforme, GBM)의 특성, 현재 치료에 활용되고 있는 화학 항암제, 그리고 교모세포종에 대한 약물 재배치(drug repurposing)에 대한 방식과 사례, 교모세포종 치료에 천연물을 적용한 사례들을 정리하여 간략하게 설명할 것이다. 특히, 기존 치료법의 한계와 새로운 치료 접근법의 필요성을 논의하며, 교모세포종에 대한 약물 재배치의 가능성과 전망을 제시하고자 한다. 이러한 통합적인 접근을 통해 GBM 환자의 생존율 향상과 삶의 질 개선을 위한 효과적인 치료 전략을 또한 모색하고자 한다.
II. 교모세포종의 특성
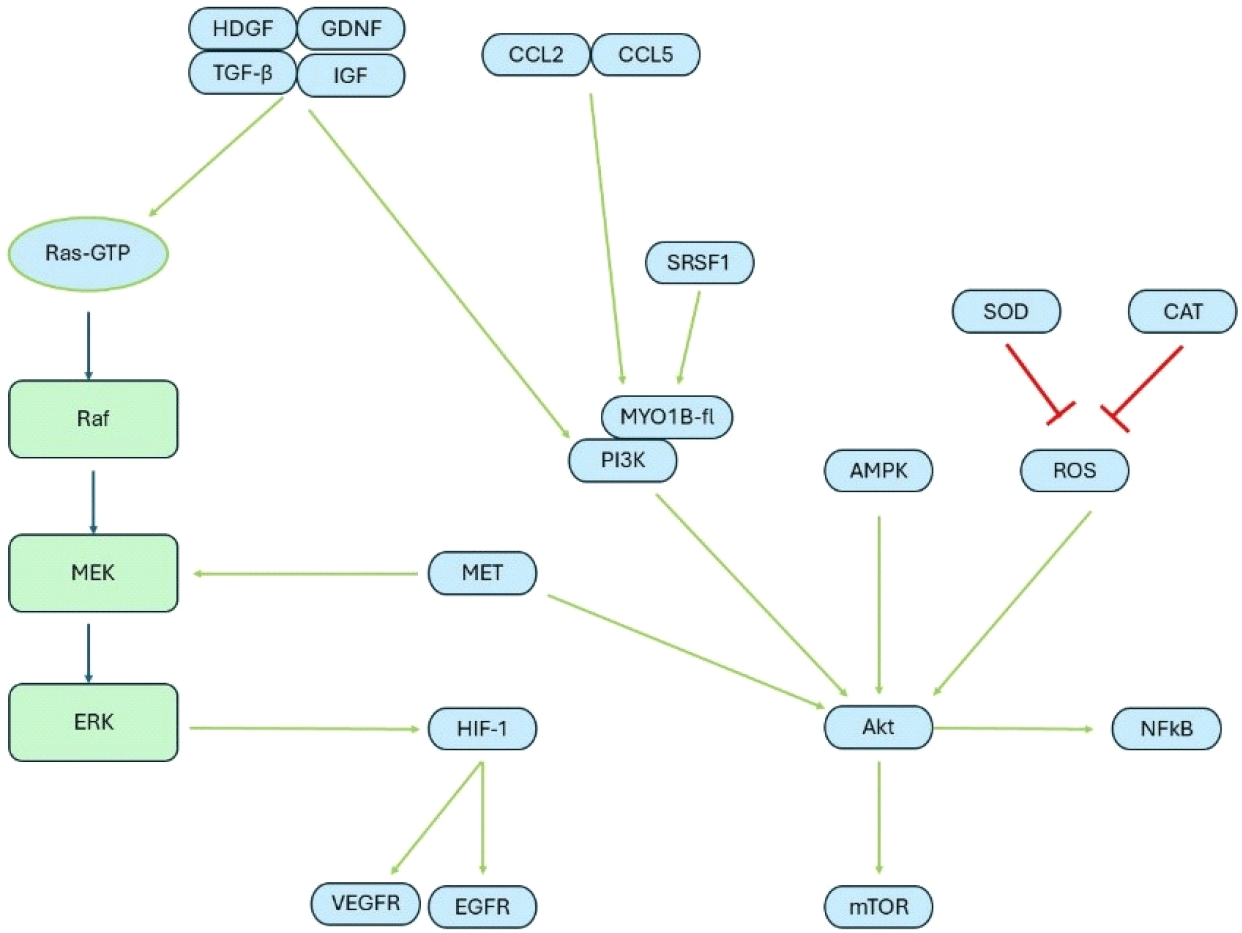
교모세포종은 지속적인 세포 증식신호를 보내는 특징이 있다. 교모세포종이 외부에서 transforming growth factor-β(TGF-β) 등 외부 종양 성장인자, C-C Motif Chemokine Ligand 2(CCL2) 또는 활성산소종(reactive oxygen species, ROS) 등을 통해 Ras-Raf) 경로 또는 Phosphoinositide 3-Kinase(PI3K)-protein kinase B(Akt) 신호경로가 활성화되면, 최종적으로 nuclear factor-kappaB(NF-κB)와 표피성장인자 수용체(epithelial growth factor receptor, EGFR), mammalian target of rapamycin (mTOR)가 과발현되면서 무한증식을 하게 된다. 또한, 종양 억제 유전자의 돌연변이로 인한 기능의 상실로 종양은 계속 자란다. 한편, 교모세포종은 저산소성 종양이다. 저산소 상태에서 영양분을 얻기 위해서 증식 신호를 통해 hypoxia-inducible factor(HIF)가 활성화되면, 혈관 내피세포 성장인자(vascular endothelial growth factor, VEGF)의 분비가 증가하면서, 혈관 내피세포에 존재하는 수용체인 vascular endothelial growth factor receptor(VEGFR)에 결합하여 혈관 내피세포가 성장하여 혈관을 종양쪽으로 끌어온다(Figure 1).
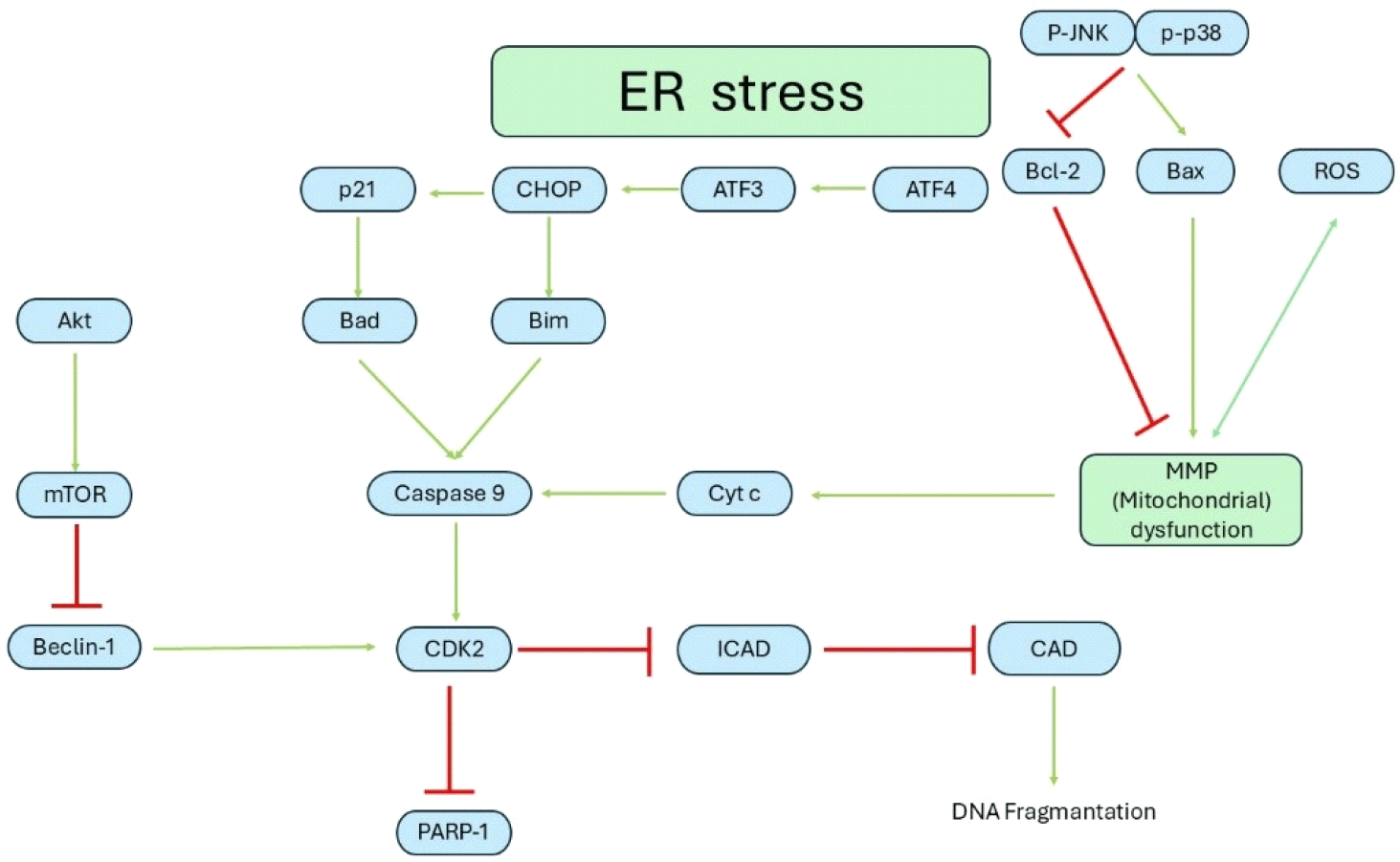
교모세포종은 세포사멸에 저항하는 것으로 알려져 있다. 교모세포종을 비롯한 모든 암은 소포체와 미토콘드리아가 활성산소종(reactive oxygen species, ROS), 세포사멸 신호를 통해서 파괴되고, 미토콘드리아에서 유출된 cytochrome C (Cyt C)가 Caspase들을 활성화시킨다. 이 활성화된 Caspase들은 coiled-coil myosin-like BCL2-interacting protein(Beclin-1)과 함께 DNA 손상을 복구하는 역할을 하는 poly(ADP-ribose) polymerase(PARP)와 정상상태에는 Inhibitor of caspase-activated DNase(ICAD)에 의해 억제되어 있던 caspase-activated DNase (CAD)가 활성화되어 DNA가 분해되며 세포사멸을 유도한다.
교모세포종은 증식신호인 Akt와 mTOR을 통해서 또는 세포사멸 저항 유전자인 B-cell lymphoma 2(BCL-2)로 인해 미토콘드리아 매개 세포사멸 경로를 막아 세포사멸을 회피한다(Figure 2).
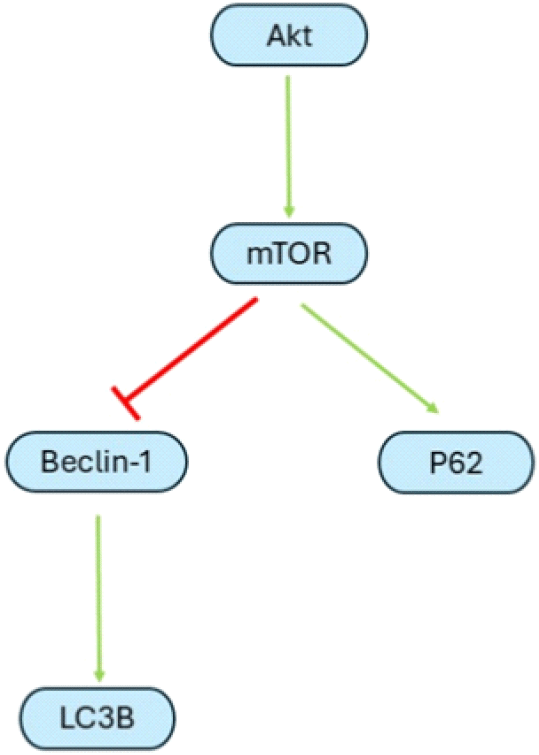
교모세포종은 자가포식을 억제하는 것으로 알려져 있다. 자가포식은 수명을 다한 단백질이나 세포소기관을 소화하여 아미노산 등으로 분해하여 다시 재사용할 수 있게 해주는데, 자가포식이 종양 증식을 유도하는지와 사멸을 유도하는지에 대해서는 상당히 논란이 많다. 자가포식을 억제하면 단백질 구조의 잘못 접힘이나 구조적 이상이 발생한 단백질이 계속 쌓이게 되어 내부에 inclusion bodies를 만든다는 원리가 중론이다. 그러나, 이게 종양세포의 사멸을 유도하거나 스트레스 조건에서 에너지원을 만들어서 종양증식을 촉진할 수도 있다.
신호경로를 살펴보자면, Beclin-1은 세포사멸에 영향을 주는 것뿐만 아니라, microtubule-associated protein 1 light chain 3 beta(LC3B) 발현을 촉진하여 자가포식 소체 생성에도 영향을 준다. 세포 증식과 종양 촉진성 염증, 종양의 침윤과 전이에 영향을 주는 AKT가 mTOR를 촉진하고, 이 mTOR는 Beclin-1을 억제하여 자가포식 소체 형성을 억제한다(Figure 3).
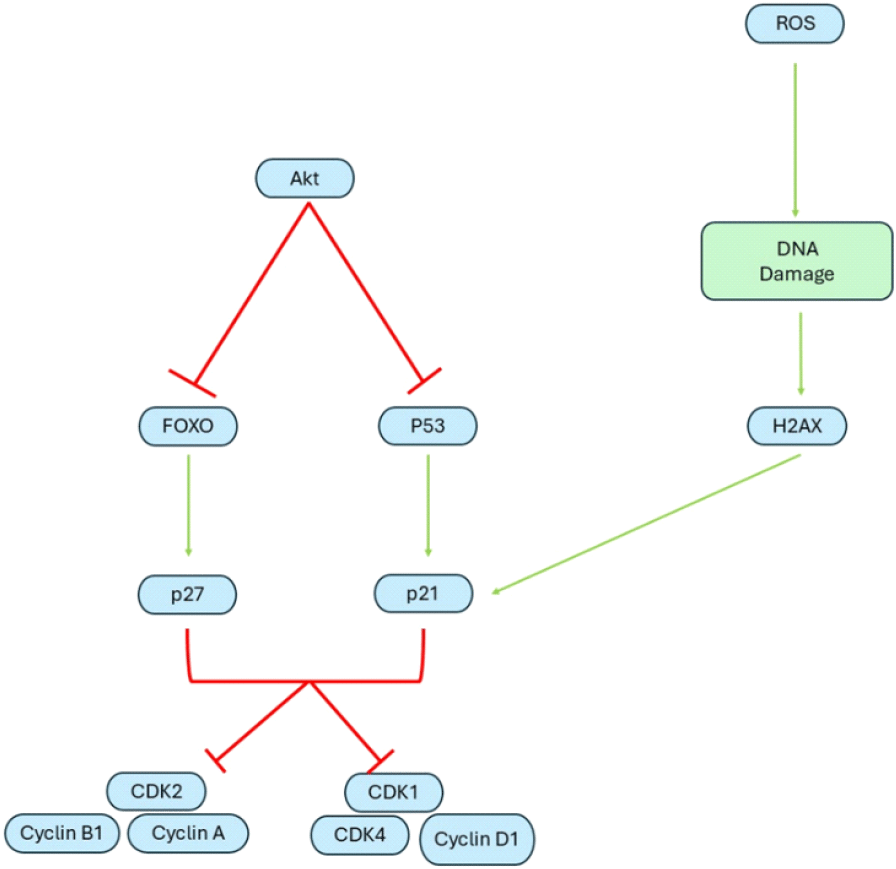
교모세포종은 일반 암과 비슷하게 세포주기가 지속되면서 분열을 계속한다는 특징을 가지고 있다. Forkhead homeobox O(FOXO)와 P53은 p27과 p21의 발현을 촉진하여 세포주기에 영향을 주는 Cyclin-dependent kinase(CDK)를 억제하여 세포주기를 정지시킨다. 또한, 활성산소종으로 인해 DNA가 손상되면 H2A family member X(H2AX)가 p21을 촉진하여 CDK를 억제하여 세포주기를 정지한다. 그러나 교모세포종은 증식신호 중 하나인 AKT가 cyclin-dependent kinase inhibitor (CDKN)을 억제하여 종양억제 유전자 중 하나인 Cyclin 유전자들을 억제하지 못하게 되어 세포주기가 지속된다(Figure 4).
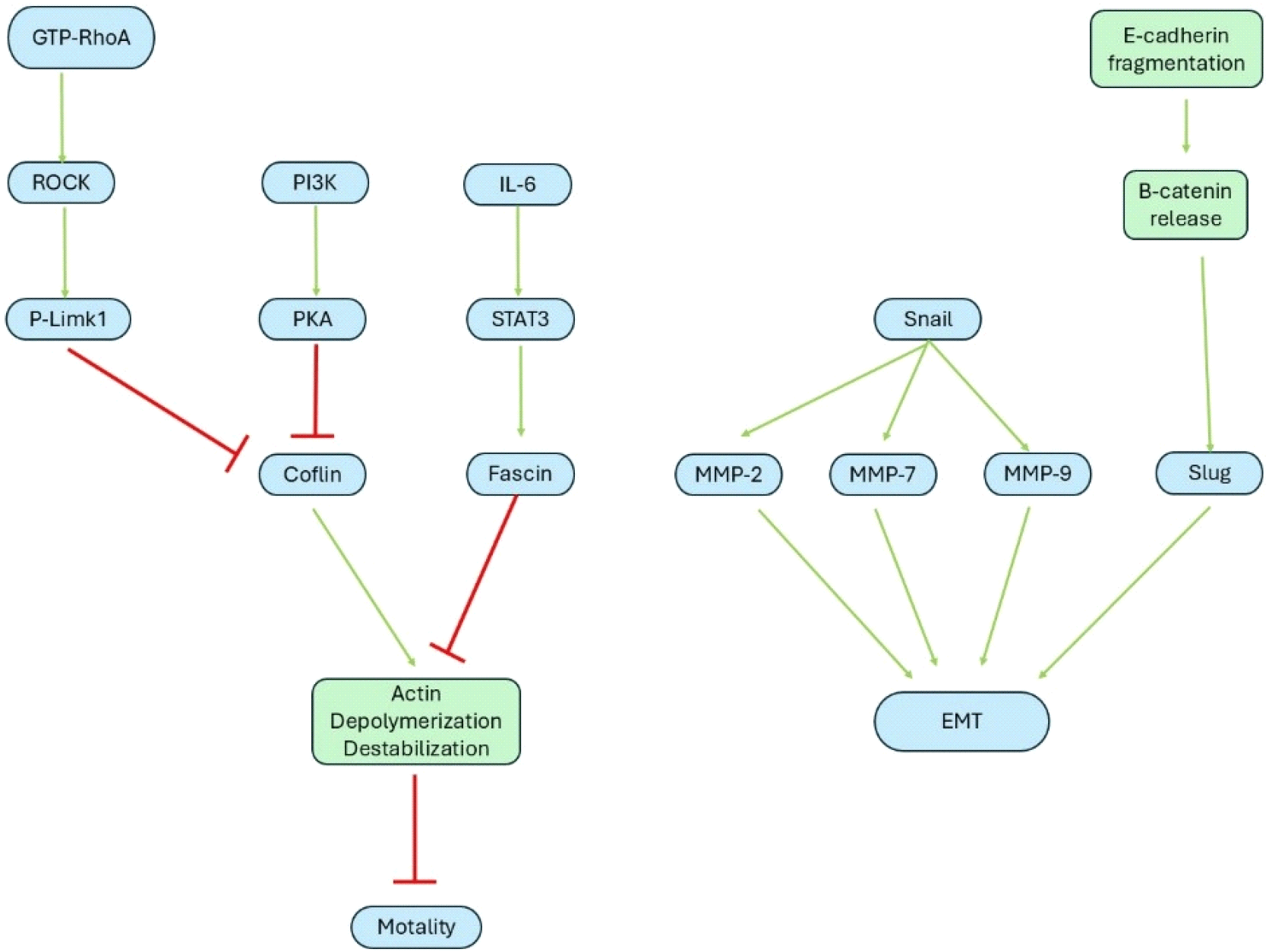
교모세포종은 침윤과 전이되는 특성이 있다. 종양이 침윤 또는 전이가 될 때, 이동성을 위해 actin이 중합된다. Ras homolog family member A(RhoA)-Rho-associated protein kinase(ROCK) 신호경로와 PI3K-Protein kinase A(PKA) 신호경로 등을 통해 actin 구조 중합을 억제하는 Cofilin을 억제하여 세포의 이동성을 높이고, 또한 증식신호와 종양 촉진성 염증신호를 통해 actin 구조 탈중합을 억제하여 세포의 이동성을 높이는 Fascin을 촉진한다. Cofilin과 Fascin은 서로 길항 역할을 한다. 또한, snail 유전자 발현을 통해서 matrix metalloprotease (MMP)가 활성화됨과 동시에, 세포를 연결하는 연접 단백질인 E-cadherin이 분해되며 세포가 떨어지고, β-catenin이 나오면서 slug의 발현을 촉진하여 종양세포의 이동성을 높인다. 그 외에도 zing finger E-box-binding homeobox(ZEB) 1/2 및 Twist1/2 같은 여러 전사인자들을 통해, 최종적으로 상피-중간엽 전이(epithelial-to-mesenchymal transition, EMT)가 이행되며, 이를 통해서 종양이 세포 외 기질(extracellular eatrix, ECM)을 분해하고, integrin에 의해 ECM 또는 기질세포 단백질에 부착하며 이동함으로써 침윤과 전이가 일어난다(11, 12; Figure 5).
III. 교모세포종 치료용 주요 화학 항암제
교모세포종을 치료하기 위해 여러 화학 항암제가 사용되고 있다. 화학 항암제에는 DNA 알킬화제, VEGF 억제제, 효소 억제제 등 여러 가지 유형이 있다. 교모세포종 치료를 위해 사용하는 주요 화학 항암제에는 DNA 알킬화제인 Temozolomide (TMZ)와 Nitrosourea 계열인 Loumustine(CCNU), VEGF 표적 단클론 항체인 Bevacizumab 등이 있으며, 그 중에서 TMZ가 주로 많이 활용되고 있다(Table 1). 화학 항암제는 수술적 제거 후 전이 및 재발을 막기 위해 추적관찰 과정에서 방사선 치료와 함께 병용하기도 한다. 그러나 화학 항암제를 지속적으로 투여할 경우, 그로 인한 내성이 발생할 가능성이 있고, 심각한 부작용을 유발할 수 있으며, 정상조직도 손상될 가능성이 있어 환자에 투여할 때 상당히 부담을 더하고 있다. 따라서 투여 시 용량조절이나 환자의 체질 등 신중을 기해야 하며, 추가적인 전이나 부작용 증상 발현이 없는지 지속적인 추적관찰이 필요하다.
| 약물 | 약물 용도 (특성) | BBB 통과 여부 | 주요 부작용 | 투여 방법 | 출처 |
|---|---|---|---|---|---|
| Temozolomide (TMZ) | DNA 알킬화제 | 통과 | 메스꺼움, 구토, 피로, 혈구감소증 | 경구 | 23, 24 |
| Bevacizumab | VEGF 억제 단클론항체 | 제한적 | 고혈압, 위장관 천공, 출혈, 혈전색전증 | 정맥 주사 | 4, 7, 31 |
| Lomustine (CCNU) | 나이트로소우레아 계열 알킬화제 | 통과 | 골수억제, 폐 섬유화 | 경구 | 21, 44, 46 |
| Carmustine (BCNU) | 나이트로소우레아 계열 알킬화제 | 통과 | 골수억제, 폐 독성 신경학적 독성, 위장관 및 간 독성 | 정맥 주사 또는 생분해성 웨이퍼 | 4, 8, 21, 44, 49 |
| Irinotecan | 토포이소머라제 I 억제제 | 통과 | 설사, 골수억제 | 정맥 주사 | 50 |
| Procarbazine (주로 병용하여 사용함) (PCV요법으로도 사용되고 있음) | DNA 알킬화제 | 통과 | 골수억제, 오심, 구토 | 경구 | 21, 51 |
| Vincristine (PCV 요법으로도 사용되고 있음) | 미세소관 억제제 | 제한적 | 말초신경병증 | 정맥 주사 | 52 |
| Pembrolizumab | PD-1 억제 면역항암제 | 제한적 | 면역 관련 부작용(갑상선기능저하증, 대장염, 갑상선 기능 항진증) | 정맥 주사 | 53 |
| Boracidenib | IDH1/2 이중억제제 | 통과 | AST · AGT · GGT 증가 (간효소 관련 수치), 관절통, 피로, 오심, 현기증, 발작 | 경구 | 54 |
| Ibocidenib | IDH1 억제제 | 통과 | 오심, 구토, 고혈당증, 실어증, 저인산혈증 등 | 경구 | 55 |
| Enacidenib | IDH2 억제제 | 통과 | 오심, 구토, 고빌리루빈혈증 | 경구 | 56 |
다음은 교모세포종 치료를 위해 주로 사용하는 3가지의 화학 항암제를 설명한다.
Temozolomide(TMZ, 상품명 Temodar)는 교모세포종 치료를 위해 화학적 요법으로 가장 많이 이용되는 약물이다(6). 2005년 FDA는 다형 교모세포종을 앓고 있는 성인 환자의 치료를 위해 TMZ를 방사선 요법과 병행한 후 유지 요법으로 승인되었다(18). DNA 알킬화제(DNA Alkylating agent)로, 친유성을 가지는 prodrug(약물이 활성화되기 전 전구체)이며, BBB를 통과할 수 있다. 생체 내 pH 산성에서 가수분해되어 일차적으로 3-methyl-(triazen-1-yl)imidazole-4-carboxamide(MTIC)로 대사된 후 다시 활성 메틸화 물질인 5-aminoimidazole-4-carboxamide(AIC), 그 다음으로 metyl-diazonium ion으로 대사된다. 메틸기를 붙이는 물질은 AIC에서 나온 metyl-diazonium ion이다. 가수분해된 약물 중 MTIC는 전체적으로 음전하를 띄는 DNA에 있는 O6(또는 N7) 위치에 있는 구아닌(또는 N3 위치에는 아데닌)에 메틸기를 붙여 O6-methylguanine을 만든다. 원래라면 구아닌에 상보적인 서열로 사이토신이 붙어야 하나, 구아닌에 메틸기가 붙음으로 인해 그 자리에 티민이 붙어버린다. 이렇게 DNA 상보서열이 잘못 결합된 상태가 지속되면, 잘못 짝지음 수정(mismatch repair, MMR)이 작동하여 DNA 이상을 수정하게 되는데, 잘못 결합한 티민과 그 주변 DNA 단일가닥만 걷어내게 되어 O6-methylguanine에 메틸기가 붙어있는 상태가 유지된다. 그러면 그 자리에 티민이 또 다시 붙게 된다. 이게 반복되어 DNA 손상이 계속되면 DNA에서 단일가닥 또는 이중가닥이 잘려지고, 제 기능을 하지 못하게 되어 세포 사멸에 이르게 할 수도 있다(199). 그러나 MGMT가 활성화되면, O6-methylguanine에 있는 메틸기를 티민과 결합하기 전 제거한다(10). 이는 DNA 손상을 상쇄시켜 세포독성 유발을 방지하고, 이를 통해서 TMZ에 대해 약물 내성을 가지게 된다(10). 또 다른 방법으로, N7-methylguanine (자발적으로 탈퓨린화되어 독성 및 돌연변이 유발부위를 형성함) 또는 N3-methyladenine(DNA 중합효소를 DNA 중합 과정에서 가로막음)이 결합한 상태에서, 염기 절단 회복(base excition repair, BER)이라고 하는 단일 뉴클레오타이드 복구로 잘못 결합된 N7-메틸구아닌 또는 N3-methyladenine을 걷어내고 다시 원래의 염기를 넣어준다(20). 따라서, TMZ는 MGMT 유전자 프로모터에 메틸기가 붙어있을 때 MGMT가 만들어지지 못해 치료효과가 높기 때문에, 이 약물을 투여할 수 있는 환자가 제한될 수 있다(21, 22). Stupp et al.의 연구에 따르면 방사선 단독 치료에 비해 TMZ를 병용한 경우, 무진행 생존율(progression free survival, PFS)이 5.0개월에서 6.9개월까지 약 2개월 연장되었으며, 전체 생존율(overall survival, OS)은 12.1개월에서 14.6개월까지 연장되는 연구 결과가 있다(23). 국소방사선 치료와 병행하는 경우 42~49일 연속 75 mg/m2 PO/IV per Day, 단일 투여의 경우 방사선 병용 단계를 완료한 이후 4주 후부터, 한 사이클은 5일간 복용 후 23일간 휴약하는 총 28일의 주기로 진행한다. 주기 1: 1~5일에 150 mg/m2 PO/IV per Day, 주기 2~6: 투여 중단 또는 중단이 필요하지 않은 경우, 주기 2를 시작하기 전에 1~5일에 200 mg/m2/day PO/IV로 증가할 수 있다. 2년 생존율은 방사선 요법과 TMZ를 병용했을 경우 26.5%, 방사선 요법 단독으로 시행한 경우 10.4%였다(23). TMZ의 부작용으로는 고혈압, 경련, 피로, 혈액 독성, 호중구 감소증, 혈소판 감소증, 두 개 내 출혈 등이 있다(23, 24).
Bevacizumab(상품명: Avastin)은, 혈관내피세포 성장인자(vascular endothelial growth factor, VEGF)를 억제하는 단클론항체(monoclonal antibody, MAB)이다. 미국 FDA에서는 2009년에 재발성, 진행성 GBM에 대해서 가속 승인을 받았다(25). 반면 유럽에서는, 다른 암(비소세포폐암, 유방암, 신장암, 대장암 등)에는 사용승인이 허가되어 있으나, 신경교종 치료에는 사용승인 허가가 이루어지지 않았다(26). Bevacizumab은 저산소성 환경에서 많이 분비되어 혈관을 신생을 촉진하는 VEGF-A를 표적으로 결합하여, VEGF-A가 그 수용체인 VEGFR-2에 결합하지 못하도록 억제한다. 이 과정을 통해서 미세혈관의 퇴행을 유도하고, 혈관신생을 억제한다(27-30). 교모세포종 치료 프로토콜에서는 10 mg/kg을 2주마다 주사제로 투여하고 있다. Bevacizumab 단독 치료의 경우 6개월 무진행 생존율이 42.6%였다. 방사선 또는 다른 항암제와 같이 bevacizumab을 투여했을 때, bevacizumab 단독치료에 비해 유의미한 PFS가 증가하는 모습을 보였으나, OS에는 큰 영향을 끼치지 않는다는 연구 결과가 있다(31-35). 그러나, 임상시험 결과가 일관적이지 않고, 전체생존율이 개선되지 않아 효과에 대해서 논란의 여지가 있다. 알려진 부작용으로는 위장관 천공(gastrointestinal perforation), 느린 상처 회복, 상처 회복 합병증(wound healing complications), 고혈압(hypertension), 혈전 색전증(thromboembolic ebents), 좌심실 기능 장애, 단백뇨(proteinuria), 두개 내 출혈(intracranial hemorrhage) 등이 있다. 또한 신경인지(neurocognitive) 기능 저하 우려가 있었다(36). 이를 대비한 치료법이 제안된 연구가 있다(37). 일부 역형성 신경교종(anaplastic glioma)(침윤성 세포)에 투여할 시 효과가 없을 수 있다. 이미 형성된 뇌혈관을 따라 발달한다는 특징이 있어 혈관을 끌어올 필요가 없고, 혈관신생을 막으면 종양 덩어리를 막을 수는 있겠지만, 이론적으로 종양 침윤과 관련된 요소가 없어진 것이 아니기 때문으로 보인다(38, 39). 또한, VEGF 억제를 통해 종양으로부터의 혈관신생을 억제하면 오히려 종양 침윤을 증가시킨다는 다소 충격적인 연구결과가 1편 있다(40). 종양 부위의 저산소 환경을 만들기 때문인 것으로 추정된다. 이는 추가적인 검증이 필요하며, 사실이라면 종양 주변에 혈관이 많은 경우에만 투여가 가능해지는 제한이 발생할 수 있어 환자에 따른 신중한 사용이 필요할 것으로 보인다.
Loumustine(CCNU)은 Nitrosourea 중 하나로, DNA(RNA) 알킬화제(Alkylating agnet)이다. Nitrosourea 는 TMZ에 이어 많이 사용하는 약물군으로, 대표적으로. carmustine(BCNU), lomustine(CCNU), cemustine(metyl-CCNU), potemustine, streptozotocin 등이 있다. 과거에는 carmustine이 웨이퍼 형태로 많이 사용되었으나, 심각한 부작용으로 인해 지금은 lomustine을 주로 사용한다(41-43). Lomustine은 친유성 물질이고 분자 크기가 작아 BBB를 통과할 수 있다. 정맥주사를 하거나, 수술적 종양절제 후 약물을 적신 생분해성 웨이퍼를 수술부위에 넣은 후 봉합하는 등 다양한 방식으로 투여된다. 또한 Procarbazine, Loumustine, Vincristine(PCV) 약물 조합요법의 한 약물 중 하나로 투여되고 있다. Lomustine은 TMZ와 유사하게 prodrug이다. 체내에서 대사되면 2-chloroethyl-garbonuim ion을 생성한다. 이 이온은 강한 친전기성을 가져서 전체적으로 음전하를 가지는 DNA나 RNA를 알킬화시키는데, DNA나 RNA에 있는 구아닌의 O6 위치에 에틸클로로기를 붙여서 이중가닥 내 가교를 만들어 강하게 결합하면서, DNA 전사와 복제를 불가능하게 만든다. 이를 통해 강력한 세포독성을 유발하여 세포를 사멸시키는 원리이다(21, 44). 그러나, lomustine에 대해서도 앞서 설명한 TMZ와 유사하게, MGMT에 의해 이중가닥 결합 및 가교반응 전, 클로로에틸기가 제거되면서 DNA 손상이 상쇄된다. 이에 따라 약물에 대한 내성이 생길 수 있으며, MGMT 프로모터가 메틸화된 경우 MGMT가 만들어지지 못해 치료 효과가 증대된다는 연구결과가 있어 이 약물을 투여할 수 있는 환자가 제한될 수 있다(22, 34, 45, 46). 따라서 환자에 따른 신중한 접근이 필요하다. 부작용으로는 골수억제 (백혈구감소증), 메스꺼움, 구토, 피로감, 구내염, 탈모 등이 있으며, 신장 독성과 폐 독성도 있다. 제일 위험한 부작용으로 폐 섬유화가 있으며, 이로 인해 투여 시 추적관찰이 반드시 필요하다. 해당 증상이 발현되면 투여를 즉시 중단하고 필요한 조치를 취해야 한다.
IV. 약물 재배치
약물 재배치란 이미 시판되고 있는 약물들이 임상적 발견이나, 실험을 통해서 새로운 효능이 확인될 경우, 해당하는 약물들을 타겟의 구조분석과 약물의 작용기전 추적을 통해 다른 증상에 적용하여 약물의 새로운 기능을 발견하는 것을 의미한다. 이미 안전성과 효능, 약동학 및 약리학적 작용기전, 예상 가능한 부작용이 검증되어 있기 때문에, 새로 개발된 혁신신약보다 안전성이 보장되어 있다. 또한, 제약사에게는 혁신신약 개발 시, 새로운 후보물질을 찾고 검증하는 것에 대한 엄청난 시간과 비용, 개발 실패에 따른 위험성을 획기적으로 절감할 수 있어, 제약업계와 의학계에서 큰 관심을 보이고 있다. 과정은 신약 개발과 다소 유사하지만, 다음과 같은 차이점이 있다. 약물의 약동학, 약리학적 작용 기전과 타겟의 구조가 검증된 약물들을 타겟 구조 또는 ligand 구조 분석 등의 방식으로 스크리닝하기 때문에, 타겟 및 약물후보 선정에 대해 스크리닝 과정이 짧고, 약동학 및 약리학적 작용기전과 타겟에 대한 효과 여부 등을 일일이 탐색 및 분석하는 과정이 줄어든다. 또한, 기존 약물을 재활용하므로 추가 공정 개발이 최소화될 수 있다. 한편, 안전성이 검증되어 부작용에 대한 위험이 감소하여, 경우에 따라 임상시험의 일부가 생략될 수 있다(57, 58).
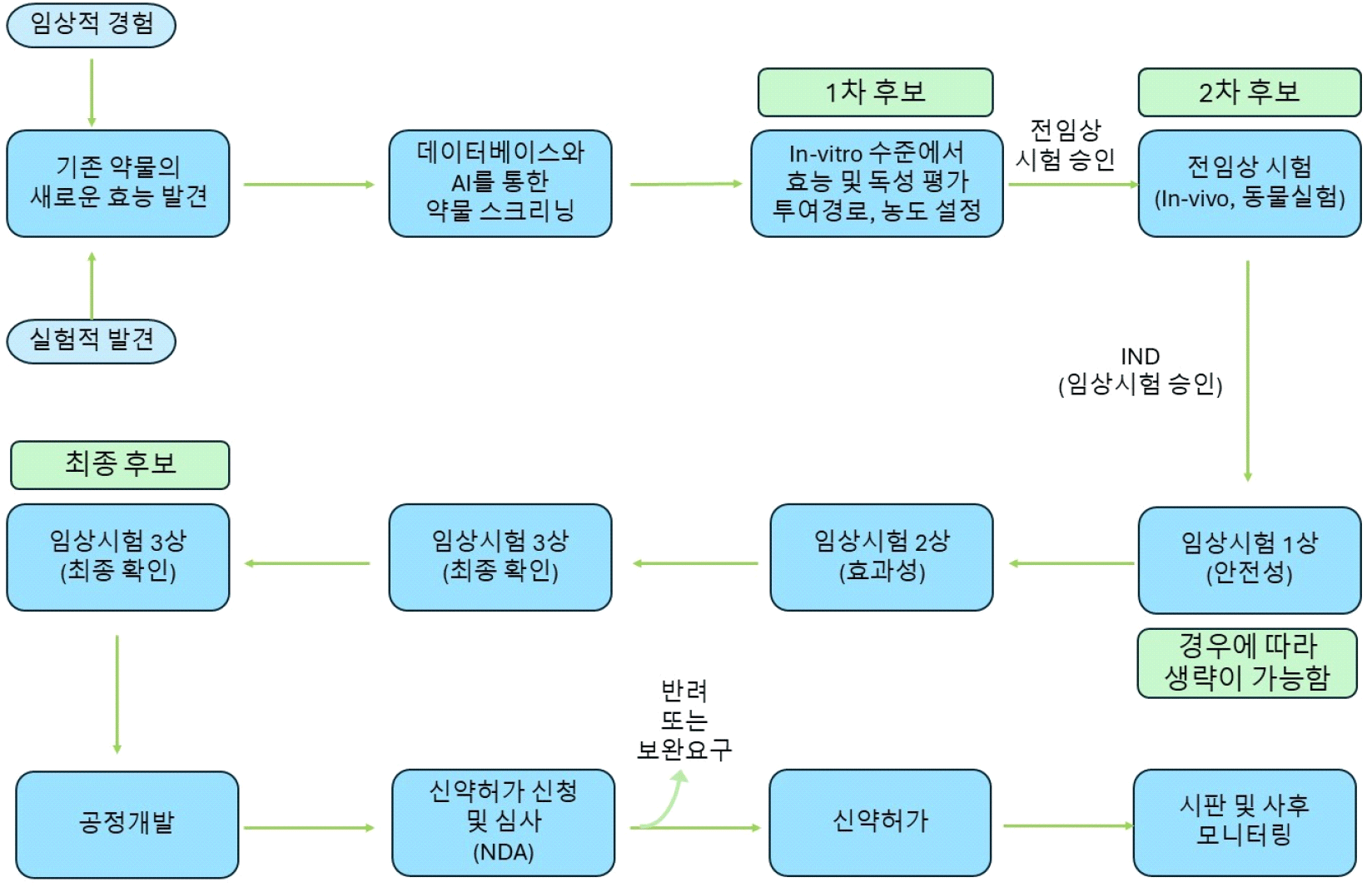
최근 실행되는 약물 재배치를 위한 과정은 크게 여섯 단계로 이루어진다. 먼저, 새롭게 기존 약물의 효능을 발견하고, 기존 약물을 적용하려고 하는 적응증을 설정한 다음, 두 번째 단계로 대량의 약물 관련 데이터가 저장되어 있는 데이터베이스와 AI에 기반한 컴퓨터 프로그램으로 약물의 기전 또는 단백질 구조 등 다각화된 스크리닝을 하거나, 임상적 경험, 독성평가 등을 통해 약물의 1차 후보를 걸러낸다. 그러면 세 번째 단계, 세포수준에서 실험을 진행하게 된다. 세포수준에서 효과가 보이는 것이 입증된 약물이 2차 후보로 걸러지면 다음 네 번째 단계에서 전임상 시험이라고 하는 동물실험을 실행하게 된다. 동물실험에서 효과가 있는 약물이 3차 후보로 걸러지면 다섯 번째로 환자들을 대상으로 임상시험을 1-3상을 시행하게 된다. 마지막으로, 임상시험을 통과한 약물이 드디어 새로운 적응증에 대해서 새로 관계당국의 심사를 통해 승인을 받으면 기존 약물을 새로운 적응증에 사용할 수 있게 된다(59-61; Figure 7).
경우에 따라서 새로 설정된 적응증에 대한 약물의 안정성과 효능을 높이기 위해 투여경로를 변경하거나, 약물전달기술(drug delivery system, DDS)을 추가적으로 적용할 수 있고, 약물의 분자구조를 변형하거나 농도를 조절하는 등 최적화 과정과 공정개발 과정을 추가로 거칠 수도 있으며, 더 나아가서 기존 약물에 기반한 유사체를 만들 수도 있다(62). 이 때에는 추가적인 세포실험과 임상시험 과정을 거치게 된다.
V. 교모세포종에서 항암 관련 약물 재배치
현재 교모세포종에 대해서 치료 전략과 여러 기존 약물들에 대해서 항암 효능을 새롭게 발견하여 재배치하는 연구가 많이 진행되어 있으며, 삼환계 항우울제(tricyclic antidepressants, TCAs) 등 향정신성 의약품, 구충제, 항바이러스제, 당뇨병 치료제 등 다양한 유형이 존재한다(6, 36, 45, 65, 66; Table 2). 교모세포종에 대해서 약물을 재배치할 때는 여러 요건을 고려해야 하며, 이는 결론 부분에 후술되어 있다. 기존 적응증에 대한 효능과 안전성, 부작용은 이미 검증되어 있고, 교모세포종에 적용하기 위한 연구와 임상시험도 활발히 진행 중이다. 그러나, 아직 기존 약물을 재배치하여 교모세포종 치료를 목적으로 승인된 약물은 현재 없다. 따라서 기존 약물에 대한 항암효과를 더 충분히 실험하고 검증해서 임상결과를 확보해야 한다. 아래에 교모세포종에 대한 재배치가 연구된 4가지 기존 약물에 대해서 서술하였다.
| 약물 | 기존 적응증 | BBB 통과 여부 | 부작용 | 작용 기전(GBM에 대해) | 출처 |
|---|---|---|---|---|---|
| Memantine | 알츠하이머병 | 통과 | 현기증 등 | N-메틸-D-아스파르트산(NMDA) 수용체 길항 등 | 87 |
| Levetiracetam | 간질 | 통과 | 졸음, 피로, 경련, 어지러움, 균형장애, 떨림, 기억상실, 조화운동불능, 기억손상, 주의력 장애 등 | p53 발현 증가, MGMT 프로모터에 대한 HDAC1/mSin3A 복합체 결합 증가 등 | 88 |
| Valproic acid | 간질, 조울증 | 통과 | 혈액 및 골수 독성, 신경학적 독성, 등 | 히스톤 탈아세틸화효소 억제로 인한 방사선 감수성 증가 G2/M 세포주기 정지 p27, p21, Bim 상향조절 ROS 수치 증가를 통한 paraoxonase 2-BIM을 통한 세포사멸 유도(PON2 감소) MMP-2, 9 억제를 통한 이동과 침윤 억제 Bcl-2, Bcl-xl, Mcl-1억제와 Bax, Bak 발현 증가를 통해 미토콘드리아 기반 세포사멸 유도 자가포식 촉진 VEGF 억제를 통한 혈관신생 억제 등 | 79, 89 |
| Disulfiram | 알코올 중독 | 통과 | 특정 신경학적 증상 등 | ALDH 억제, 프로테아좀 및 NF-κB 경로 억제, 구리와 결합하여 세포 독성 증가 등 | 81, 82, 83, 84, 85 |
| Dimetylfumaric acid | 다발성 경화증, 건선 | 통과 | 림프구 감소증, 알부민소변, 홍반, 복통, 구토, 안면홍조, 발진 등 | NF-κB 신호 억제를 통한 항혈관신생과 전이 억제, 항염증, 세포사멸 유도, BBB 무결성 유지 MMP활성 감소 및 Nrf2 활성화로 전이 억제 등 | 90, 91 |
| Sertraline (세로토닌 재흡수 억제제) | 우울증 | 통과 | 오심, 발한, 설사, 졸음, 피로, 성기능장애 등 | 세포사멸 유도, AKT 하향조절, ROS 생성유도, 세포증식 억제, 세포주기 정지, DNA 단편화 유발, 칼슘이온 수준 조절하여 세포의 이동과 침입 감소, 항혈관신생, ser/gly 합성 경로 억제 등 | 92, 93, 94 |
| Imipramine (삼환계 항우울제) | 우울증 | 통과 | 위장장애, 졸음, 어지럼증, 무기력, 흥분, 불안, 불면, 입마름. 햇빛에 피부 민감해짐, 변배, 배뇨장애, 시야흐림, 땀 증가 등 | PI3K/Akt/mTOR 신호 경로 억제 NFkB 발현 억제 YAP억제 통한 종양 증식 억제, 자가포식 유도 등 | 95, 96, 97 |
| Metformin | 제2형 당뇨병 | 통과 | 위장관 효과 등 | 전자전달계 복합체 I 억제, AMPK 활성화, 세포주기 정지, 세포사멸유도, 자가포식 유도 등 | 68, 69, 74 |
| Sulfasalazine | 류마티스 관절염, 궤양성 대장염 | 확인되지 않았음 | 호중구감소증, 백혈구감소증 등 | 시스틴 흡수 억제, GSH 수치 저하, ROS 증가, 세포사멸 유도, NFkB 억제 등 | 98, 99, 100 |
| Afrepitant | 화학요법 유발 구토 | 통과 | 구역, 두통, 피로, 설사, 운동실조 등 | MMP억제 통한 전이 억제 세포사멸 유도 물질 P와 Neurokinin -1 차단 등 | 101, 102 |
| Ritonavir | HIV 치료 | 확인되지 않았음 | 단독사용으로 인한 부작용은 알려지지 않았음. 설사, 구토, 피로, 오심, 두통, 근육통, 손발 마비, 췌장염, 간 문제, 고혈당 등 | 침윤, 전이 억제, 프로테아좀 억제 로피나비르와 리토나비르 병용 투여 시 ROS 증가, caspase 독립적 세포사멸 유도 TMZ 병용 시 효과 증가 MMP 발현 감소 등 | 103, 104, 105 |
| Lopinavir | HIV 치료 | 확인되지 않았음 | 단독사용으로 인한 부작용은 알려지지 않았음. 설사, 구토, 피로, 오심, 두통, 근육통, 손발 마비, 췌장염, 간 문제, 고혈당 등 | MMP 발현 감소 로피나비르와 리토나비르 병용 투여 시 ROS 증가, caspase 독립적 세포사멸 유도 TMZ 병용 시 효과 증가 등 | 106 |
| Valganciclovir | CMV 감염 예방 | 확인되지 않았음 | 설사, 발열, 상기도 감염, 요로감염, 구토, 호중구감소증, 백혈구감소증, 두통 등 | CMV 감염 예방 | 107 |
| Itraconazole | 항진균제 | 확인되지 않았음 | 두통, 구토, 복통 등 | 라노스테롤 14-아데메틸레이스 억제, 스테롤 생합성 억제, 콜레스테롤 이동 방해 및 무질서한 배분, AKT1-MTOR 신호 전달의 억제, 자가포식 유도, 그리고 최종적으로 세포 증식의 억제 등 | 108 |
| Minocyclin | 테트라사이클린 유래 항생제 | 통과 | 탈모, 가려움, 발진, 구토, 복통, 식욕부진, 간 장애, 어지러움, 두통 등 | MMP 억제하여 종양침윤 및 전이 억제, p38 MAPK의 억제하여 종양성장 억제, 자가포식, 세포사멸 유도 등 | 109 |
| Chloroqine | 말라리아, 자가면역질환 | 통과 | 시야흐림, QT 간격 연장, 고농도에서 상당한 독성 등 | 세포사멸 유도, 자가포식 억제, DNA 간접 손상 등 | 78, 110 |
| Hydroxychloroqine | 말라리아, 자가면역질환 | 통과 | 고용량 독성 등 | 자가포식 억제 / DNA 간접 손상 등 | 110 |
| Mefloqine | 말라리아 | 통과 | 위장관 장애, 두통, 어지러움, 수면장애, 발진, 우울증, 환각, 불안 등 | 세포사멸 유도, 항 혈관신생 DNA 간접 손상, 자가포식 억제 등 | 110, 112 |
| Mevendazole | 기생충 감염 | 확인되지 않았음 | 간효소(ALT, AST) 상승, 혈구 수 감소 등 | 미세소관 중합 억제, 포도당 흡수 억제, multityrosine kinase억제 등 | 113, 114 |
| Haloperidol | 정신병, 조현병, 급성 조증, 양극성 장애, 투렛 증후군 (DRD2 길항제) | 통과 | 졸음, 인지기능 장애 등 | 세포사멸 유도, 증식억제, 전이 억제, G2/M 세포주기 정지 P-gp기능 차단 통한 BBB투과성 증가 등 | 115, 116 |
| Trifluoperazine | 정신병, 조현병 | 확인되지 않았음 | 졸음, 어지러움, 피로감, 시야흐림, 구강건조, 식욕감퇴 등 | 칼모듈린에 결합하여 억제함. 이를 통해 IP3R 칼슘 통로를 열어 세포 내 비정상적 칼슘 방출 방사선 유도 표현형 전환을 방지하여 방사선치료 효능 향상 등 | 117, 118, 119 |
| Chlorpromazine | 정신병, 조현병 | 통과 | 기립성 저혈압, 혈압저하, 빈맥, 부정맥. 빈혈, 구토, 설사 등 | 증식억제, 자가포식유도, 화학 항암제 저항성 GBM 세포의 CcO억제를 통한 COX4-1 발현을 선택적으로 억제, Cx43 발현 하향조절 통해 TMZ내성 극복 등 | 120, 121, 122 |
| Olanzapine | 조현병, 양극성 장애, 헌팅턴병 | 통과 | 졸음, 체중증가, 콜레스테롤 증가, 혈당 및 중성지방 수치 상승, 당뇨, 현기증, 기립성 저혈압, 발진, 부종, 식욕증가 등 | Wnt/β-catenin 경로, C-Jun 경로 억제, 세포 증식 감소, NF-kB억제 통한 자가포식 유도, TMZ와 사용 시 시너지 효과 등 | 123, 124 |
| Quetiapine | 조현병, 양극성 장애, 우울증, 불안 장애 | 확인되지 않았음 | 졸음, 어지러움, 무기력, 체중증가, 부종 등 | 고용량 투여 시 세포 주기 G2/M 억제, PI3K 경로 억제 교모세포종 줄기세포(GSCs)의 분화를 촉진하고 Wnt/β-catenin 신호 경로를 억제 등 | 125, 126 |
| Amitriptyline | 우울증, 불안 장애, 편두통 예방 | 통과 | 배뇨곤란, 빈뇨, 변비, 구강 건조, 졸음, 빈맥 등 | NF-kB 발현 억제 ROS 생성 증가, 미토콘드리아 매개 세포사멸 유도 등 | 127 |
| Fluoxetine | 우울증 | 통과 | 두통, 구토(구역), 불면증, 피로, 설사 등 | GluR1 결합, AMPA 수용체 활성화, 미토콘드리아 Ca2+ 유입 증가로 세포사멸 유도 스핑고미엘린 대사 방해하여 EGFR 신호경로 억제, SMPD1 억제 등 | 128, 129 |
| Fluvoxamine | 우울증 | 통과 | 구역, 식욕감퇴, 변비, 설사, 소화불량, 구강건조, 복통, 어지러움, 불면증, 두통, 발한 등 | 액틴 중합 억제를 통한 GBM 세포 침윤 감소, mTOR 억제 등 | 130, 131 |
| Thioridazine | 조현병 | 통과 | 심실성 부정맥, 심장 리듬 이상, 졸림, 어지러움, 구강건조 등 | AMPK 활성 촉진, 자가포식 및 세포사멸 유도 DNA 단편화 및 Caspase활성 증가 TMZ 병용 시 시너지효과 등 | 132, 133, 134 |
| Diazepam | 불안 장애, 근육 경련, 마취 (벤조디아제핀 계열 전신 마취제) | 통과 | 졸음, 휘청거림, 시력장애, 구토, 식욕부진, 언어장애, 두통, 설사, 변비 등 | Rb 비활성화를 통해 G0/G1 세포주기 정지, 하이페리신 및 에토포시드 유도 세포독성 촉진 등 | 135 |
| Phenformin | 제2형 당뇨병 치료 | 확인되지 않았음 | 식욕부진, 오심, 구토, 설사, 체중감소, 요산혈증 등 | 전자전달계 복합체 I 억제, AMPK 활성화 mTOR 경로 억제, 세포주기 정지, 침윤 억제, 세포사멸 유도 GSC에 대한 성장, 자가 재생 억제 NFkB, STAT3 경로 억제, miR-124, 137 및 let-7의 발현을 증가 등 | 136, 137 |
| Repaglinide | 제2형 당뇨병 치료(인슐린 분비 촉진제) | 확인되지 않았음 | 저혈당, 복통, 설사, 구토, 변비, 알레르기 등 | 세포사멸 유도, BCL-2, PD-L1, Beclin-1 수준 감소 FOXO3 억제 등 | 138, 139 |
| Flavopiridol | 암 치료 | 확인되지 않았음 | 설사, 염증성 증후군, 저혈압 등 | CDK 억제 통한 세포주기 정지 세포사멸 촉진, FOXM1 억제, 대사 억제, NF-kB 억제, PARP 억제, GPR78/PERK/IRE1α 억제 p27KIP1 활성의 상향 조절 통한 증식 억제 등 | 140, 141, 142 |
| Gefitinib | 폐암 치료 | 제한적 | 피부발진, 설사, 오심, 구토, 피로감 등등 | EGFR 억제 | 143, 144 |
| Lovastatin (스타틴 계열) | 고지혈증 치료 | 통과 | 근육 장애, 간 기능 장애, 신부전 등 | HMG-CoA 환원효소 억제 통한 세포사멸 촉진, 항증식, 항전이, 방사선 민감성 증가, 자가포식 촉진, 항혈관신생 TRAIL과 사용 시 효과 GSC 성장억제 등 | 145, 146 |
| Simvastatin (스타틴 계열) | 고지혈증 치료 | 통과 | 복통, 설사, 근육 장애, 두통, 어지러움. 등 | HMG-CoA 환원효소 억제 통한 세포사멸 촉진 TGF-B 억제를 통한 증식 억제 PI3K/Akt 신호전달 경로 억제 항증식, 항전이, 자가포식촉진, 항혈관신생 등 | 147, 148 |
| Pravastatin (스타틴 계열) | 고지혈증 치료 | 통과 | 복통, 설사, 두통, 어지러움. 등 | HMG-CoA 환원효소 억제 통한 세포사멸 촉진, 항증식, 항전이, 항혈관신생, 자가포식 등 | 147, 148 |
| Propentofylline | 혈관성 치매, 알츠하이머병 노령견 치료 | 통과 | 구토, 오심, 안면홍조, 속쓰림 등 | TROY 경로 억제하여 종양 침윤 전이 억제, TMZ에 대한 민감도 증가, AKT, NF-κB 및 Rac1 활성화 억제 | 149 |
| Pimozide | 투렛 증후군, 정신분열증, 양극성 장애 | 통과 | 언어장애, 심장박동이상, 감정기복 등 | 세포사멸 유도 c-Myc, Mcl-1 및 Bcl-2의 발현 억제 방사선 민감도 향상 등 | 150, 151 |
| Tamoxifen | 유방암 예방 및 치료 | 통과 | 자궁암, 뇌졸중, 시력 문제, 폐색전증 위험 등 | EGFR 발현 감소 미토콘드리아 매개 세포사멸 유도, TMZ와 병용 시 시너지 효과 등 | 152, 153 |
| Nimotuzumab | 암 치료 | 제한적 | 고열, 오한, 오심, 구토, 피부발진 등 | EGFR 억제 | 154 |
| Cetuximab | 대장암 치료 | 제한적 | 시력이상, 어지러움, 피부발진, 심장박동이상 등 | EGFR 억제 | 155 |
| Niclosamide | 구충제, 암 치료 보조제 | 확인되지 않았음 | 구토, 오심, 복통, 가려움증 등 | NOTCH, mTOR, NF-kB 신호 경로 억제 등 | 156 |
Metformin은 2형 당뇨병 치료를 위해 사용하는 프랑스 라일락(Galega officinalis)에서 유래한 구아니딘의 구조를 변형한 biguanide class 약물이다. 경구투여 약물이며, 위장관에서 빠르게 흡수되어 친유성기가 많아 BBB를 쉽게 통과할 수 있다. 당뇨병이 아닌 환자가 복용해도 안전한 약물로, 부작용으로 요산혈증이 발생할 수 있으나 매우 드물다. Metformin은 간에서의 포도당 신생을 감소시키고, 말초에 있는 세포에 대한 인슐린 감수성을 높여서 포도당의 소모량을 높여 혈중 포도당 농도를 감소시키며, 위장관에서의 포도당 흡수도 줄여주는 역할도 한다(67). 또한, 미토콘드리아의 호흡, 즉 산화적 인산화를 억제하는 것으로 알려져 있다. 현재 metformin은 항암활성 기전이 복잡하고 명확하게 밝혀져 있지 않았으며, 기전을 밝히기 위해 지속적으로 연구가 이루어지고 있다. metformin이 미토콘드리아 호흡인 산화적 인산화 과정에서 전자전달계 1에서 유비퀴논(ubiquinone)에 전자를 전달하는 것을 차단해 산화 스트레스를 낮춰주고, ATP가 생성되지 못해 AMP가 축적되며, 특히 간세포에서 포도당 신생성을 억제하고, ATP 생성을 촉진하는 AMPK가 작동함과 동시에 세포 대사를 조절하는 mTOR를 억제하여 단백질 합성을 못하게 되고, 세포주기가 정지되면서, 종양의 성장과 증식을 억제하여 세포사멸을 유도하고, 전이를 막는 것으로 현재 알려져 있으나, 다른 연구 결과에서는 간세포에서는 AMPK가 없어도 metformin이 직접 포도당 신생성을 억제할 수 있다는 결과가 있다. TMZ와 병용 시 치료효과를 높인다는 연구결과가 있다(64, 67-73). 현재 metformin에 대해서 임상시험이 활발하게 진행 중이며, 긍정적인 결과도 보고되었으나, 일부 실험 에서는 실패했다는 사례도 보고되고 있다. 주된 이유로 GSC에서의 대사과정 변화 때문인 것으로 추정된다. 또한, 다른 약물과 병용하는 실험도 진행 중으로, 추가적인 임상연구를 통해 작용기전과 효과를 검증할 필요가 있다(74).
Chloroquine(CHQ) 또는 hydroxychloroquine은 주로 말라리아 치료제로 사용되며, 간헐적으로 류마티스 관절염, 아메바성 감염, 루푸스병에도 사용된다. CHQ는 주로 경구 투여되나, 피하주사나 근육주사, 직장 내 투여도 가능하며 친유기가 있어 BBB를 통과할 수 있다. 현재 알려진 항암 관련 작용 기전은, 1) 리소좀-자가포식소체 기능 억제로 자가포식을 억제한다. 역설적이게도, 이는 p62 축적으로 이어지고, NF-κB의 활성화로 이어진다(75, 76). 2) P53 세포사멸 유전자 발현을 촉진한다. 3) 미토콘드리아 스트레스를 유발하여 세포사멸을 유도한다. 이 1)~3) 과정을 통해 자가포식을 통해 활성화된 p62/NF-κB 증식 신호경로와 리소좀/미토콘드리아 세포사멸 신호경로와 충돌한다. 4) DNA 손상을 유발하고, 복구기전을 막는다(77, 78). 5) 또한, CHQ는 in vitro에서 신경교종 줄기세포(glioma-initiating cell, GIC)의 방사선 민감도를 향상시켜 교모세포종에 대한 방사선과 CHQ 병용 치료의 타당성을 시사한다. 방사선과 함께 후기 자가포식 억제제인 CHQ는 G0/G1 세포주기 정지를 일으키고, GIC의 세포사멸을 촉진하며, GIC에서 방사선에 의한 DNA 손상의 복구를 손상시켜 GIC의 종양구 수와 직경의 감소가 관찰되었다(76). 그러나 일부 연구결과에서 효과를 보기 위해서는 최대 20 μM을 투여해야 하는 것으로 나오는데, 이는 상당히 고농도에 해당한다(64, 76, 78). 부작용으로는, 근육 문제, 식욕 부진, 설사, 피부 발진, 고용량 독성 등이 있으며, 심각한 부작용으로는 시력 저하, 근육 손상, 발작, 혈구 수치 감소 등이 있다. 현재 항암효과에 대해서 많은 임상시험이 진행 중이나, 정확한 항종양 활성과 작용기전이 규명되지는 않았다. 따라서 현재는 교모세포종의 보조요법으로 사용하는 것이 적절할 것으로 보인다. 또한, CHQ에 대한 추가적 연구를 통해서 정확한 기전을 밝히고, 최적의 투여 용량과 방법, 병용효과 등을 규명해야 한다(78).
Valproic acid(VPA)은 항경련제, 기분안정제로 사용되는 향정신성의약품으로, 히스톤 탈아세틸화효소 억제제 (histone deacetylase inhibitor, HDACI)이다. 경구투여와 정맥주사가 가능하다. TMZ, luteolin, gefitinib, 방사선치료, 면역 관문 억제제 등과 병용 시 효과가 있다는 연구들이 있다. 따라서 단독 사용보다는 병용투여하여 치료하는 것이 더 효과적일 것으로 보인다. 그러나, 정확한 작용기전과 최적의 사용법을 확립하기 위해 추가적인 연구가 필요하다. 부작용으로는 메스꺼움, 구토, 졸음, 구강 건조가 있으며, 심각한 부작용으로는 췌장염이 있다. 또한, 임산부에게 투여할 경우, 태아기형을 유발할 수 있다(64, 79). 현재 VPA 이외에도 phenobarbital, carbamazepine 등 많은 항간질제 및 향정신성 의약품에 대한 항종양 활성이 많이 연구되고 있다.
Disulfiram(상품명: Antabuth)은 아세트알데히드 탈수소효소 억제제(acetaldehyde dehydrogenase inhibitor, ALDH)로, 음주가 고통스러운 경험이라는 충격요법 형태의 알코올 중독 치료제로 사용되었으나, 사회적 부작용이 심해 현재 국내에서는 판매가 중단되었으며, 해외에서의 반입도 불가능하다(80). 1일 1회 경구투여되는 약물로 친유기가 있어 BBB를 통과할 수 있으며 흡수율이 높다는 특징이 있다. GBM은 다른 세포보다 구리 농도가 높은데, disulfiram은 체내에서 대사되며, diethylthiomethylcarbamate(Me-DTC)를 만들어 ALDH를 억제하는데, 이 대사체가 구리와 킬레이트 결합하여 복합체(Cu(DTC)2)를 형성하여 펜톤반응(구리 이온과 수산화기 라디칼 생성)을 일으켜 산화 스트레스를 통해 세포독성을 일으키고. NF-κB, NPL4(nuclear protein localization protein 4), SOD(superoxide dismutase) 등을 억제한다. 또한, 구리가 펩타이드 결합에 끼어들면서 protease를 억제하여 DNA 복구를 손상시킨다(81-85). disulfiram을 투여 중일 때는 아세트알데히드를 축적시킬 수 있어, 심하면 급성 알코올 중독으로 심하면 사망에 이를 수 있다. 현재 disulfiram의 항암 작용은 여러 임상 실험 등에서 효과가 입증되어 있으나 불충분하고, 임상시험에 따라 결과가 매우 다양하고 일관적이지 않아 추가적으로 많은 임상시험이 진행 중이며, 더 많은 연구가 필요하다(86).
VI. 교모세포종에 대한 천연물 기반 약물 재배치
천연물은 말 그대로 자연에서 얻어진 물질로, 정확한 정의는 유기체인 생물에 의해 생성되고, 자연계에서 발견되는 화합물 또는 대사산물을 의미한다. 주로 2차 대사산물을 의미하며, 생존에 필요한 대사산물을 제외한 부가적인 물질들을 말한다. 천연물은 의약품, 건강기능식품, 화장품, 기능성화장품 등에 이용되고 있다. 천연물은 자연에서 얻어진다는 특성으로 인해 화학 항암제보다 안전하다는 인식이 있고, 부작용에 대한 우려가 다소 적다. 또한, 천연물들은 매우 다양한 구조를 가지고 있다. 구조가 복잡하지 않다면 인공적으로 합성을 시도할 수 있어, 원가절감 측면에서 연구와 개발이 활발히 진행되고 있다. 따라서 천연물 기반 약물 재배치가 항암이나 증상 치료에 대해서 주목을 받고 있다.
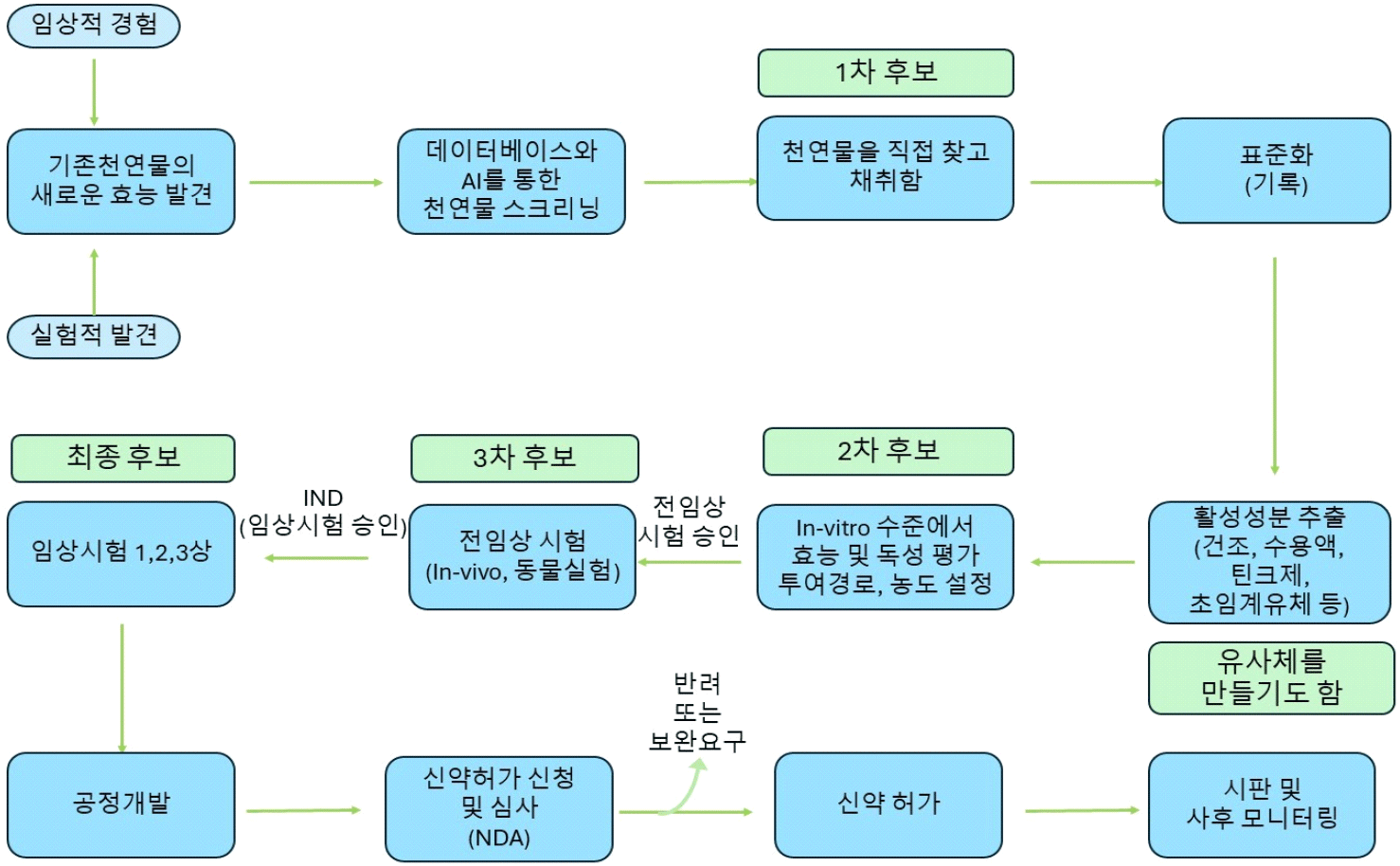
천연물 기반 약물 재배치는 기존에 알려져 시판되고 있는 천연물들에 대해서 임상적 경험이나 실험을 통해서 효과를 확인하여 기존에 알려진 효능과는 다른 효능을 발견하여 새로운 증상 치료에 활용하는 것을 의미한다. 과정은 위에서 서술한 일반적인 약물재배치와 유사하지만, 천연물을 자연에서 채취하여 표준화 과정을 거친 후, 활성 성분을 추출하는 과정이 더해지며, 실험을 통해 안전성 및 효과, 작용기전 등을 확인하고 평가하게 된다. 또한 천연물 성분의 생체 효용성을 높이고 대량생산을 대비하기 위해, 구조가 복잡하지 않을 경우 인공적으로 합성을 시도하거나, 구조를 약간 변형하여 유사체를 만들기도 한다. 또한, 일반약물 재배치와 마찬가지로 DDS 등 추가적인 공정개발이 필요할 수 있으며, 새로운 투여경로와 투여농도를 설정하고 시험하는 과정도 거치게 된다(Figure 8).
최근에는 천연물을 하나하나 대입하여 실험했던 것과 달리, 위에서 서술하였듯이 AI와 데이터베이스의 발달로, in silico 방식으로 천연물의 구조와 효능을 스크리닝하여 약물을 재발견하는 데에 상당한 편리성을 제공하고 있다. 이는 일반적인 약물 재배치와 마찬가지로, 약물개발에 대한 시간과 비용을 획기적으로 줄여주며, 안전성과 효과를 더 높일 수 있다는 장점을 가지고 있다. 현재 알려진 천연물 또는 새롭게 발견되는 천연물을 교모세포종에 적용하는 연구가 Table 3에 정리된 물질들 외에도 여러 물질에 대해서도 이루어지고 있으며, 단독 투여보다는 병용 연구가 많다(157-160; Table 3). 그러나, 천연물 기반 약물을 교모세포종 치료를 위해 재배치하는 것에 대해서 현재 많은 연구가 이루어지지는 못한 상황이며, 작용 기전이 불분명한 경우가 많다.
| 물질명 | 출처 | 기존 적응증 | 효과 | BBB 통과여부 | 출처 |
|---|---|---|---|---|---|
| Angelica sinensis 추출물 | Angelica sinensis (당귀) | 혈액순환 개선, 생리불순, 항염증, 관절염, 뇌졸중 후유증 치료 등 | p53 의존적/독립적 세포사멸 유도, caspase 독립적 경로 세포사멸 유도 G0/G1 세포주기 정지 등 | 확인되지 않았음 | 185, 186, 187 |
| Hyperforin (HP) | Hypericum perforatum (St John’s wort) | 항우울제, 경미한 우울증 치료 등 | MMP 발현 감소 통한 종양침윤 억제, 세포사멸 유도, 항 세포 사멸 관련 단백질 발현 억제 등 | 확인되지 않았음 | 188, 189 |
| Polyphenolic procyanidin B2 (PB-2) | Hypericum perforatum | 항산화, 항염증, 심혈관 건강 개선, 지방간 및 대사 증후군 완화, 신경 보호 등 | G1 세포정지 및 세포사멸 활성 유도 등 | 확인되지 않았음 | 190 |
| Hypericin (HY) | Hypericum perforatum | 광감작제, 항우울제 | 광산화 스트레스 증가 및 세포사멸 경로 활성화를 통한 종양세포 사멸 유도 등 | 확인되지 않았음 | 191 |
| n-Butylidenephthalide (BP) | Angelica sinensis | 항암제, 신경보호 효과 | 미토콘드리아 의존적 세포 사멸 유도, p53 및 p21 경로 활성화를 통해 종양 성장 억제. G0/G1 세포사멸 정지 등 | 확인되지 않았음 | 185 |
| Flavonoid-rich fraction 6 (Fr6) | 크랜베리 | 항산화, 항염증, 요로 감염 예방 | G1 세포 주기 정지 및 세포사멸 유도 등 | 확인되지 않았음 | 190, 192 |
| Proanthocyanidins (PAC) fraction | 크랜베리, 포도씨, 포도 껍질, 사과, 계피, 코코아 콩, Pinus massoniana 껍질 | 항산화, 심혈관 건강 개선 | G2/M 세포 주기 정지, 세포사멸 유도, 세포 증식 억제, HIF-1α 매개 MMP-2 및 VEGF 발현 하향 조절 통한 침윤 및 혈관신생 억제, 미세혈관 내피세포 발현 하향 조절, P-gp 단백질 조절 통한 BBB 투과 증가 등 | 가능 | 190, 192 |
| Tinospora cordifolia 메탄올 추출물 (TCE) | Tinospora cordifolia | 면역 강화, 항염증. | GFAP 발현 증가, C6 신경교종 세포 분화 유도 G0/G1 및 G2/M 세포주기 정지 G1/S기 특이적 단백질인 cyclin D1 및 항세포사멸 단백질 Bcl-xL의 발현을 억제 등 | 확인되지 않았음 | 193 |
| Thymoquinone (TQ) | Nigella sativa 씨앗 오일 | 항염증, 항암제, 면역 조절. | P62 발현 증가 통한 자가포식 활성 억제 및 Caspase 독립적 경로 세포사멸 유도, 세포 증식 억제 등 | 확인되지 않았음 | 156 |
| Brazilin | Caesalpinia sappan | 혈액순환 촉진, 항염증 | 세포사멸 증가, 세포 증식 억제 Caspase-3, 7 발현 감소, PARP 분해 등 | 확인되지 않았음 | 194 |
| Δ(9)-Tetrahydrocannabinol (THC) | Cannabis (마리화나) | 항구토제(항암 화학요법 보조), 식욕 촉진 | 세포사멸 증가, 세포 증식 및 혈관신생 감소, 종양 성장 억제 등 | 확인되지 않았음 | 195 |
| Cannabidiol (CBD) | Cannabis (마리화나) | 간질, 다발성 경화증(MS), 신경 보호 | 세포사멸 증가, 세포 증식 및 혈관신생 감소, 종양 성장 억제 등 | 확인되지 않았음 | 195 |
| Wogonin | Scutellaria baicalensis (꿀풀과) | 항염증, 진정제 | G1 세포주기 정지 및 세포사멸 유도 등 | 확인되지 않았음 | 196, 197 |
| Curcumin | Curcuma longa (강황) | 항염증, 항산화, 암 예방 및 치료 보조 | MMP-2, 9 발현 하향 조절 침윤 억제, 세포사멸 유도, NFκB 축 조절, 자가포식 유도 항세포사멸 유전자 하향 조절, stat3 경로 억제 AKT 신호 전달 약화 통한 종양 성장 억제, G2/M세포주기 정지 TMZ 감수성 증가, 세포 생존력 감소 등 | 가능 | 169, 171, 198 |
| Zeng Sheng Ping (ZSP) | 6가지 중국 전통 약초 조합 | 암 예방 및 치료 보조제 (특히 간암, 폐암, 위암 등) | Notch 신호 억제, Notch2 및 Hes1 하향 조절, CD133/Nestin 발현 감소 등 | 가능 | 199 |
| Andrographolide | Andrographis paniculata | 항염증, 면역 조절 | G2/M 기 정지, PI3K/AKT/mTOR 신호 경로 억제 통한 증식 억제, 종양침윤 억제 등 | 가능 | 200, 201 |
| Jaceosidin | Artemisia argyi | 항염증, 진통제 | G2/M 기에서 세포사멸 유도, 세포 증식 억제, 미토콘드리아 매개 세포사멸 유도 등 | 확인되지 않았음 | 202 |
| Resveratrol | 포도, 땅콩, 오디, 레드 와인 | 항산화, 심혈관 건강 개선, 항암 효과 | 자가포식 유도, S-G2/M 세포 주기 정지, MGMT 발현 하향 조절 통한 TMZ 저항성 감소, survivin 및 Bcl-2 발현 감소, ROS 생성 증가 통한 세포사멸 증가, AMPK 경로 활성화, mTOR 신호 억제 통한 종양 성장 억제, BBB 무결성 보호 MMP-9 및 TIMP-1 발현/활성 조절 등 | 확인되지 않았음 | 164, 165, 166, 167, 203 |
| Tagitinin C | Tithonia diversifolia | 전통적으로 항염증제, 해열제, 말라리아 치료제로 사용 | 자가포식 및 세포사멸 상호작용, 세포 성장 억제 PARP, p-p38, ULK1, LC3-II 발현 증가, survivin 발현 하향 조절, G2/M 세포주기 정지 등 | 확인되지 않았음 | 204, 205 |
| PCH4 | Angelica sinensis (n-butylidenephthalide 유도체) | 없음 | JNK 경로 조절, Nur77 발현 감소, 세포사멸 유도 등 | 확인되지 않았음 | 206, 207 |
| γ-Mangostin | Garcinia mangostana | 항염증, 항산화, 면역 조절 | NK 세포 활성화, 세포 성장 억제 ROS 생성, 미토콘드리아 기능 장애 유도 등 | 확인되지 않았음 | 208 |
| Inositol hexaphosphate (IP6) | 옥수수, 곡물, 견과류, 고섬유 식품 | 항암제 보조제, 면역 강화 | Bax:Bcl-2 비율의 증가와 Cyt C 및 Smac/Diablo의 세포질 수준의 상향 조절 및 세포 생존 인자 하향 조절, Calpain 및 caspase-3 활성 증가, BIRC-2 및 telomerase 감소 등 을 통한 세포사멸 유도 | 확인되지 않았음 | 209, 210 |
| Methyl gallate | Spondias pinnata | - | 세포사멸 유도 ERK1/2 활성화, AKT 활성 감소 등 | 확인되지 않았음 | 211, 212 |
| Ruta graveolens L. | Ruta graveolens L. | 진정제, 소화 촉진 (전통적으로 신경 안정 및 소화 불량 치료) | 세포사멸 유도 ERK1/2 및 AKT 활성화, 종양 침윤과 전이 억제 등 | 확인되지 않았음 | 213, 214 |
| Oridonin | Rabdosia rubescens | 항암제, 염증 억제 | U87MG 교모세포종 세포 세포사멸 유도 RanGAP1 감소 및 RanGTP 축적, Bcl-2, YAP, c-Myc 단백질 발현 억제, Bax, caspase-3, p-YAP 단백질 발현 증가 등 | 확인되지 않았음 | 215, 216 |
| Deoxypodophyllotoxin (DPT) | Dysosma versipellis | 항암제(전통적으로 종양 치료) | 세포사멸 유도, G2/M 세포 주기 정지 유도 등 | 확인되지 않았음 | 217 |
| Ardipusilloside I (ADS-I) | Ardisia pusilla A. DC | - | 세포사멸 유도, 종양 성장 억제, 생존율 증가 세포 주기 조절 단백질 발현 감소, 미토콘드리아 막 전위 제거 VEGF, CRP, TNF-α, IL-6 감소 등 | 확인되지 않았음 | 218, 219, 220 |
| Curcuma amada Roxb. 초임계 CO2 추출물 | Curcuma amada Roxb. (망고진저) | 항염증, 항산화, 항당뇨, 항암, 항균, 간 보호 | STAT3, Bcl-2, COX-2, Akt 등 발현 감소, Bax 비율 증가 통한 세포사멸 유도, VEGF 하향 조절을 통한 항혈관신생 등 | 확인되지 않았음 | 221, 222, 223 |
| Hedyotis diffusa Willd 추출물 | Hedyotis diffusa Willd | 항염증, 항암제 보조제 | S/G2-M 세푸주기 정지, MMP 분해를 통한 종양침윤 및 전이 방지, Bcl-2/Bax 비율 감소, Akt 억제 ICAM-1 및 VCAM-1 억제 등 | 확인되지 않았음 | 224 |
| Icariin | Herba epimedium | 성기능 개선, 골다공증 예방 및 치료 | 증식 억제, 세포사멸 유도, 이동 및 침윤 방지, TMZ 세포독성 증가 Akt, NF-κB 활성 약화 등 | 확인되지 않았음 | 225, 226, 227 |
| Hispidulin | Saussurea involucrata Kar. | 항염증, 항산화, 항암, 항경련, 진정제, 골 흡수 억제 | 테모졸로마이드 항종양 효과 증강 AMPK 활성화, 2 세포주기 정지 등 | 확인되지 않았음 | 228, 229 |
| Olea europaea 잎 추출물 | Olea europaea (올리브) | 항산화, 심혈관 건강 개선 | GBM 줄기세포 치료 반응 개선, 항증식 효과 miRNA 발현 조절 (miR-181b, miR-153, miR-145, miR-137, let-7d) 등 | 확인되지 않았음 | 230, 231 |
| Ficus carica Latex 추출물 | Ficus carica (무화과) | 소화 촉진, 변비 완화 | STAT3 신호전달 억제, ERK1/2 억제 GO/G1 세포주기 정지, let-7d 발현 유도를 통한 종양침윤 및 전이 방지 등 | 확인되지 않았음 | 232, 233 |
| Honokiol | Magnolia officinalis | 진정제, 신경 보호 효과 | M1 대식세포 상향 조절, M2 대식세포 억제, AKT 억제 세포사멸 유도, Bcl-2 발현 감소, STAT3 하향조절 및 MAPK 활성화 등 | 확인되지 않았음 | 233, 234, 235, 236, |
| Rhazya stricta 추출물 | Rhazya stricta | 매독, 기생충 감염, 고혈당, 류머티즘, 감기, 염증성 질환, 당뇨병, 피부 질환 (여드름), 흉통 완화 등 | 미토콘드리아 세포사멸 경로 활성화 등 | 확인되지 않았음 | 237 |
| Zingiber officinale 추출물 | Zingiber officinale (생강) | 소화불량, 메스꺼움, 관절염, 생리통, 감기 증상 완화, 항염증, 항산화, 심혈관 건강 개선 | 미토콘드리아 세포사멸 경로 활성화, 종양 침윤 억제, 항세포사멸 단백질 발현 억제 등 | 확인되지 않았음 | 238, 239 |
| Berbamine 유도체 (BBMD3) | Berberis 계열 식물 | 혈당조절, 콜레스테롤 감소, 혈압조절, 항염증, 항균 등 | 세포 생존력 억제 및 세포사멸 유도 miRNA-4284 및 JNK/AP-1 신호 경로 유도 등 | 확인되지 않았음 | 240 |
| Withaferin A | Withania somnifera (아쉬와간다) | 스트레스 완화, 항염증, 면역 강화 등 | EMT억제 통한 종양침윤 및 전이 억제 VEGF 억제 통한 혈관신생 억제 MGMT 발현 감소 통한 TMZ 민감도 증가 G2/M세포주기정지 AKT/mTOR등 다양한 신호경로 억제 등 | 가능 | 175, 178, 182, 184 |
| Lycorine | Sternbergia lutea | 항염증, 항암, 등 | EGFR억제 통한 증식신호 억제 등 | 확인되지 않았음 | 241 |
| Perillyl alcohol | 페릴라민트, 라벤더 등 | 항암, 항염증 등 | Fas매개 세포사멸 유도, G2/M 세포주기 정지 VEGF 억제 메발론산 경로 억제 등 | 확인되지 않았음 | 242, 243, 244 |
| Limonene | 감귤류 껍질 (레몬, 오렌지 등) | 소화기 건강 개선, 항염증 등 | TMZ 병용 시 G0/G1 세포주기 정지, 세포사멸 유도, 종양침윤 및 전이 방지 등 | 확인되지 않았음 | 245, 246 |
| Isochaihulactone | Bupleurum scorzonerifoliu (Nan-Chai-Hu) | 암, 월경장애, 발열, 말라리아, 인플루엔자 치료 등 | 세포사멸 유도 ER 항상성 붕괴 등 | 확인되지 않았음 | 247 |
| Kukoamine A (KuA) | Lycium chinense (구기자) | 항염증, 혈압 조절 등 | 증식 억제, 세포사멸 단백질 증가, 항세포사멸 단백질 감소 등 | 확인되지 않았음 | 248 |
| Nardostachys jatamansi Rhizome 추출물 (NJRE) | Nardostachys jatamansi | 진정제, 신경 보호 효과 등 | 세포사멸 유도 및 G0/G1 세포 주기 정지, 세포 증식 억제, DNA 단편화 등 | 확인되지 않았음 | 249 |
| Myricetin (MYR) | 과일, 야채, 향신료 등 | 항산화, 심혈관 건강 개선 등 | 세포 사멸 유도 미토콘드리아 세포사멸 유도, 다제내성 억제 등 | 확인되지 않았음 | 250, 251, 252 |
| Melissa officinalis L. | Melissa officinalis (레몬밤) | 진정제, 소화 촉진 등 | 세포사멸 유도 등 | 확인되지 않았음 | 253, 254 |
| Rosmarinic acid (RA) | Melissa officinalis (레몬밤) | 항산화, 항염증 등 | 세포사멸 유도 등 | 확인되지 않았음 | 254 |
| Acori graminei Rhizoma 휘발성 오일 (VOA) | Acori graminei (Rhizoma) | 알츠하이머병, 기억력 개선, 학습 장애 완화, 뇌신경 보호, 간질 및 중추신경계 질환 치료 등 | 세포사멸 및 자가포식 유도 p53/AMPK 신호경로 유도 등 | 확인되지 않았음 | 255, 256 |
| Ginsenoside Rg3 | Panax ginseng (인삼) | 면역 강화, 혈액 순환 개선 등 | 증식 억제, 세포 주기 정지, 세포사멸 유도, 종양 침윤 및 전이 억제, HUVEC 증식 억제, TMZ 민감도 증가, 혈관신생 억제 VEGFA 및 BCL-2 발현 감소 등 | 확인되지 않았음 | 257, 258 |
| Zataria multiflora Boiss 추출물 | Zataria multiflora | 항염증, 항산화, 항균, 항진균, 면역조절, 진통 등 | 방사선 치료 효과 증강, GBM 세포 방사선 감수성 증가 등 | 확인되지 않았음 | 259 |
| Shikonin | Lithospermum erythrorhizon (자초) | 항염증, 항산화, 상처 치유, 항암 효과, 항균, 피부 질환 치료 (습진, 화상 등). | 세포사멸 촉진, MMP-2, 9 발현 억제 통한 전이/침윤 감소AKT/PI3K 발현 감소 통한 증식 저해 등 | 확인되지 않았음 | 260, 261 |
| Propolin G | 대만 프로폴리스 | 항균, 항염증, 항산화, 면역력증진 등 | Caspase. 매개 세포사멸 유도 둥둥 | 확인되지 않았음 | 262 |
| Berberine | Coptis chinensis, Hydrastis canadensis, Berberis aristata 등 | 혈당 조절, 콜레스테롤 감소, 혈압 조절 등 | TGF-β1/SMAD2/3 및 AMPK/mTOR/ULK1 경로의 억제를 통한 증식 억제, 종양 침윤 및 전이 억제 등 | 확인되지 않았음 | 263, 264, 265 |
| MSC500 | 8가지 한약재 조합 | 언급되지 않았음 | CSC 유사 개체군 감소, 약물 내성 감소 ALDH 활성 감소, ABC 수송체 발현 하향 조절 등등 | 확인되지 않았음 | 266 |
| Naringin | 감귤류, 베르가못, 토마토 등 과일 | 체중 조절, 지질 대사 개선, 항산화, 항염증 등 | FAK / CyclinD1 활성 억제하여 증식억제, FAK/bads 경로에 영향을 주어 세포사멸 유도, FAK/mmps억제하여 종양침윤 및 전이 억제 TMZ 병용 시 시너지 효과 등 | 확인되지 않았음. | 267, 268 |
| Astaxanthin | Haematococcus pluvialis 갑각류, 어류 | 눈 건강 개선, 면역력 강화, 피부건강증진 등 | ROS 증가, 세포사멸 유도, 증식억제 등 | 가능 | 269, 270 |
| Arctigenin | Arctium lappa | 신경보호, 항산화, 항바이러스 등 | AKT/mTOR 억제 통한 증식신호 억제 자가포식 유도 등 | 확인되지 않았음 | 271 |
| Quercetin | 브로콜리, 적양파, 사과, 적포도, 체리, 베리 | 항산화, 항염증, 심혈관 건강 개선 등 | 세포 증식 억제, TMZ 감수성 증가, 세포사멸 유도 IL-6 매개 STAT3 활성화 감소 통한 침윤 및 전이 억제, Hsp27 발현 억제 등 | 가능 | 161, 162, 163 |
| Celastrus orbiculatus 추출물 | Celastrus orbiculatus (노박덩굴) | 관절염, 전염병, 치통, 생리통 치료 등 | E-cadherin 발현을 증가시키고, MMP-2 및 MMP-9 발현을 감소 통한 전이 및 침윤 억제 등 | 확인되지 않았음 | 272 |
| Plumbarzine | Plumbago zeylanica L. | 항암제, 항균제 등 | PI3K/Akt 감소 통한 세포 주기 정지, MMP 2, 9 발현 억제 통한 침윤과 전이 방지 | 확인되지 않았음 | 273 |
| Tetrandrine | Stephania tetrandra S. moore | 고혈압 치료제, 면역억제제 등 | GBM 8401에서 세포 방사선 감수성 증가, 세포사멸 유도 신경교종 유사 줄기세포에서 β-catenin 경로 억제, P-gp 억제 등 | 가능 | 274, 275, 276 |
| Osthole | Cnidium monnieri 열매 | 진통제, 간질 치료 등 | MMP-13 발현 감소 통한 침윤 및 전이 억제, 증식 억제 등 | 가능 | 277 |
| Cucurbitacin B | Cucurbitaceae 계열 식물 | 항암 효과, 간질환 및 염증성 질환 치료 등 | 세포 증식 억제, 세포 이동/침습 억제 JAK/STAT3 신호 경로 억제, 액틴 및 미세소관 네트워크 파괴 항혈관신새 등 | 확인되지 않았음 | 278, 279, 280 |
| Chokeberry extract | Aronia melanocarpa | 항산화, 심혈관 건강 개선 | 세포 생존력 감소, 괴사 유도 MMP-2, 14, 16, 17 mRNA 수준 하향 조절 | 확인되지 않았음 | 281, 282 |
| Tricosanthin | Trichosanthes kirilowii | 낙태 유도제, 바이러스 감염 억제 | G2/M세포주기 정지 세포 증식 억제, 세포사멸 증가 LGR5 및 Wnt/β-catenin 발현 감소 | 확인되지 않았음 | 283, 284 |
| Betulin acid | Betula pubescens, Prunella vulgaris | 항염증, 항바이러스, 면역조절, 항종양 등 | 세포사멸 유도, Akt/NFκB-p65 신호경로 억제 통한 증식 억제, ROS 형성, 항혈관신생, 항전이 등 | 가능 | 285 |
| Variolin B, meridianins | Ascidian aplidium meridianum | 언급되지 안았음 | 세포 증식 억제 CDK 활성 억제 등 | 확인되지 않았음 | 286 |
| Sesquiterpene lactone | Cynara scolimus L. | 항염증, 해열, 고지혈증, 항말라리아 등 | ROS증가 통한 세포 사멸 유도 등 | 확인되지 않았음 | 287 |
| Salidroside | Rhodiola crenulata | 항피로, 신경 보호, 심혈관 보호, 항염증 | 세포 증식 억제, Wnt/β-catenin 신호 억제, 등 | 확인되지 않았음 | 288, 289 |
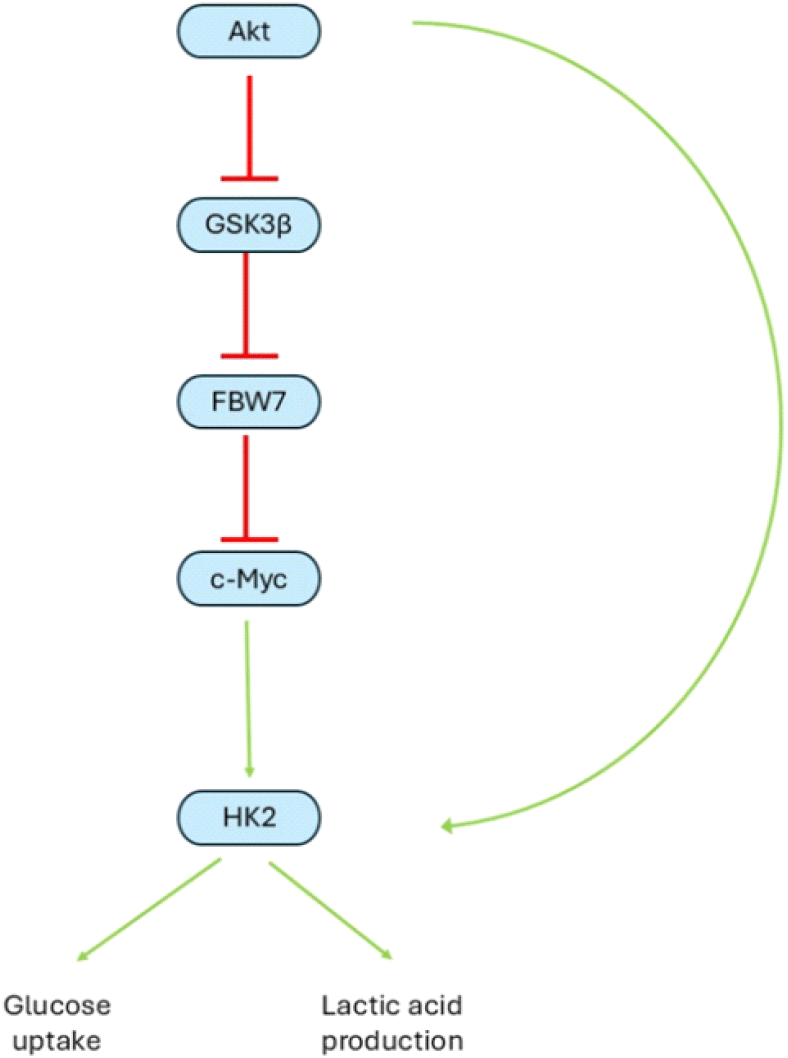
| Xanthohumol | Humulus lupulus L. (Cannabaceae)(홉) | 항산화, 항균 효과 | GBM 세포 성장 억제 c-myc와 HK2 GSK3β 발현억제를 통한 해당과정 억제 등 | 확인되지 않았음 | 14 |
| Opuntiol | Opuntia humifusa | 항염증, 항산화, 피부 광노화 방지 등 | 세포사멸 유도 등 | 확인되지 않았음 | 290 |
| Ochnaflavone | Ochna kibbiensis, Ochna schweinfurthiana | 항염증, 항산화, 항균, 항말라리아, 상처 치유 등 | U-1242 세포에 대한 세포독성 등 (확실한 작용기전 확인되지 않았음) | 확인되지 않았음 | 291 |
| Toosendanin | Melia toosendan | 구충제(기생충 감염 치료), 항염증, 항암 효과 | 세포 증식 억제, 대식세포 면역억제 방지 | 확인되지 않았음 | 292, 293 |
| Saponin-1, Saponin-B | Anemone taipaiensis | 진정제, 항염 효과, 통증 완화 | 세포사멸 유도, 종양 증식 신호 억제, 세포 주기 정지, Fas-l 활성화, Bax/Bcl-2 비율 증가 등 | 확인되지 않았음 | 294, 295 |
| Eckol | Ecklonia cava | 항산화, 항염증, 신경 보호, 항암 효과, 방사선 보호 | GBM 줄기 유사세포 특성 억제, 종양 성장 억제 PI3K/Akt, Ras/Raf-1/Erk 신호 억제 등등 | 확인되지 않았음 | 296 |
| Carnosine | 주로 육류에서 발견됨 | 항산화, 항염증, 심혈관 건강 개선 등 | U87, T98G에서 PI3K/Akt/mTOR 독립적 세포사멸 유도 (확실한 작용기전 확인되지 않았음) | 확인되지 않았음 | 297 |
여기서는 천연물 중에서 교모세포종 치료를 위해 재배치된 대표적인 4가지 물질에 대해서 소개한다.
Quercetin은 여러 야채와 과일에서 발견되는 천연 플라보노이드로, 항산화 효과로 많이 알려져 있다. 다음과 같은 항종양 활성이 알려져 있다(161). 1) 종양 촉진성 염증인 IL-6과 연관한 STAT3 활성을 억제하여 종양 침윤을 억제한다. 2) 약물 저항성을 부여하는 Heat shock protein 27(HSP27)을 억제한다. 3) p53 돌연변이가 발생한 GBM 세포에서 미토콘드리아 매개 세포사멸을 유도한다(162). 4) GSK-3β/β-catenin/ZEB1 신호 경로 억제를 통한 종양 세포 이동 및 침윤 억제, 5) TMZ와 병용 시 TMZ 감작성을 증가시켜 시너지 효과를 내는 것으로 알려졌다(163). 그러나 임상적 유효성을 확립하기 위해서는 추가적인 작용기전 규명과 연구가 필요하다.
Resveratrol은 포도, 오디, 땅콩 등에 들어있는 폴리페놀(polyphenol)로, 플라보노이드(flavonoid) 중 하나이다. 항염증, 항산화, 신경보호, 혈당저하 및 심혈관계 질환 예방 효과가 있는 것으로 알려져 있다. 다음과 같은 항종양 활성이 알려져 있다. 1) XIAP, Survivin, Bcl-2 등 세포사멸 저항 단백질 발현을 억제하여 세포사멸을 촉진한다(2). MGMT를 억제하여 TMZ의 효과를 증가시키는 효과가 있다(164, 165). 3) ROS 생성을 증가시켜 세포사멸을 유도하고, 4) AKT 비활성화 및 p53 활성화하여 세포주기를 정지시키고, 5) STAT3 신호 경로를 억제하여 종양 침윤과 전이, 그리고 세포증식을 억제하고 사멸을 유도한다. 6) 교모세포종 줄기세포(glioma Stem Cell, GSC) 억제, 7) 방사선 치료와 병용 시 시너지 효과를 내는 것으로 알려졌다(166-168). 그러나, 임상적 유효성을 확립하기 위해서는 추가적인 작용기전 규명과 연구가 필요하다.
Curcumin은 카레의 재료이자 향신료 중 하나인 강황 (Curcuma longa)의 뿌리줄기에서 초임계 유체 등의 방식으로 추출한 주황색의 폴리페놀 성분이며, 친유기가 있어 BBB를 통과할 수 있다. 항산화, 항염증, 항균, 항허혈성, 항류마티스, 불안, 우울증, 대사증후군, 항암효과 등 여러 효과가 있는 것으로 알려져 있으나, 약물로는 승인되지 않았다. 현재 여러 활성 기전이 알려져 있다. 1) Fas, CD95, TRAIL 신호 경로 및 caspase를 활성화하여 세포사멸을 촉진한다(169). 2) NF-κB/hedgehog signaling을 억제하여 세포의 전이를 억제하고, STAT3, AP-1과 MAPK 억제를 통해 침윤을 막는다. 3) VEGF, MMP9, bFGF, NF-κB 등을 억제하여 혈관신생을 억제한다. 4) EGFR, AKT/PKB, NF-κB를 억제하고, p53, RB 발현 수준 증가를 통해 관련 신호 경로 조절을 통해세포주기를 정지하고 증식을 억제한다. 5) STAT3, JAK/STAT 경로, ILs/NF-κB 종양 촉진성 염증을 방지한다(170). 6) 종양의 면역 회피 미세환경에서 종양 관련 미세아교세포를 종양 공격성 염증을 유발하지 않는 M2 형태 억제 및 종양 공격성 염증을 유발하는 M1 형태 전환을 유도한다(17). TMZ와 함께 사용하면 DNA 복구경로를 억제하여 시너지 효과를 내는 것으로 알려졌다. 그러나, 체내 흡수율이 낮고, 생체 이용률이 낮다는 단점이 있다. 이를 보완하기 위해서 적절한 투여농도와 명확한 기전을 추가로 밖히는 등 추가 연구가 필요하다(171).
Witherferin A는 주로 네팔, 인도, 중동에서 자생하는 가지과 식물 중 하나인 아쉬와간다(Withania somnifera, Ashwagandha)에서 추출되는 위타놀라이드 계열의 스테로이드성 락톤이며, 특히 뿌리 부분은 인도의 전통 의학인 아유르베다(Ayurveda)에서 약초로 사용했다(172). 스트레스, 항염증, 면역력 향상에 효능이 있는 것으로 알려졌다. 또한, BBB를 통과할 수 있는 것으로 알려졌다. 다음과 같은 항종양 활성이 알려져 있다. 1) E-Cadherin 발현을 증가시키고, EMT를 억제하여 종양의 침윤을 막는다. 2) VEGF를 억제하여 혈관 신생을 막는다. 3) 종양 촉진성 염증을 억제한다. 4) MGMT의 발현을 감소시켜 TMZ 저항성 세포의 민감도를 증가시킬 수 있다. 5) ROS 생성 및 ER 스트레스를 유도하여 미토콘드리아 매개 세포사멸을 유도한다. 7) NF-κB, Akt/mTOR, MAPK, p53 등 다양한 신호 전달 경로를 조절하여 G2/M 세포주기 정지를 유도하고, 증식을 저해한다. 8) Ferroptosis를 유도한다고 알려져 있다. GSC에도 효과를 보여, 이는 종양 재발 방지에 중요한 역할을 할 수 있다(173-184). 병용치료를 시행하면 더 큰 효과를 낼 수 있을 것으로 보인다. 그러나, witherferin A의 정확한 작용 기전을 밝히고, 최적의 투여 용량 및 방법, 다른 치료법과의 병용 효과 등을 더욱 명확히 규명할 필요가 있다.
VII. 결 론
교모세포종은 매우 진행이 빠르고, 생존율이 낮으며, 재발률이 높은 난치성 암이다. 기존 항암제를 사용하기에는 내성이 생길 가능성과 부작용의 우려가 있어 환자에 대한 투여에 부담을 더하고 있다. 천연물 기반 약물 재배치는 기존 항암제 투여와 항암제 신약 개발에 대한 단점들을 보완할 수 있는 새로운 대체 기법으로 주목받고 있다. 최근에는 컴퓨터 기법이 진보하면서 데이터베이스에 AI 기술이 접목되어 약물의 기전과 분자구조, 타겟을 훨씬 더 빠르고 정확하게 추적하고, 스크리닝이 가능하게 되면서, 연구개발의 편의성과 경제성을 더하고 있다. 그에 따라, 더 부작용 우려가 적고 특이적이며, 안전하면서 인체 친화적으로, 기존 치료법과의 조합을 통한 다각적인 치료가 가능해져 더 높은 치료 효과도 기대할 수 있게 될 것으로 보인다.
기존에 사용하는 약물과 천연물을 재발견하여 GBM에 적용할 때, 고려해야 하는 사항이 있다. 먼저, 작용성분이 뇌, 특히 교모세포종에 도달하기 위해서는 뇌혈관장벽을 통과해야 하고, 다시 유출되는 것을 최소화하여 생체 이용률을 높이는 것이 약물 전달에 있어 여전히 가장 큰 어려움으로 작용하고 있다. 특히 뇌혈관장벽은 내피세포가 단단하게 연접으로 붙어 있고, 400~600 Da 사이의 친유성 분자와 특정 수용체를 통해서만 통과가 가능하고, 친수성 분자와 너무 큰 고분자의 경우 통과가 어렵다(199-301). 또한, 약물이 성공적으로 종양에 도달하여도, 종양 내의 이질성으로 인한 치료약물 회피 가능성과 약물에 대한 내성이 발생할 가능성이 있다는 점은 여전하며, 부작용이 아예 없지 않다는 것도 고려해야 한다. 또한, 약물이 기존 증상에 사용하는 농도와 실험을 통해 새롭게 적용해야 하는 농도, 그리고 기존과는 투여경로가 다를 수 있어, 이에 대한 약리학적 검증과 안전성, 그리고 생체 이용률이 평가되어야 하며, 약물의 초회 통과 효과 및 대사과정도 고려되어야 한다. 그리고 특이적으로 작용해야 한다는 점도 고려해야 한다. 따라서 단일 약물 투여보다는 수술 및 약물과 방사선 치료 등을 결합한 복합치료가 효과를 더 극대화할 수 있고, 생존율을 향상시킬 수 있을 것으로 보인다.
현재 기존에 시판되는 화학적 합성 기반 약물들에 대해서 현재 항암과 GBM 관련 약물 재배치 연구가 활발히 진행되고 있으며, 단독 투여보다는 병용투여 연구가 많이 진행되고 있다. 그러나, 재배치된 약물에 대해서는 아직 사용승인이 난 재배치 약물이 없다. 천연물 기반 약물에 대해서도 항암과 관련 약물 재배치 연구는 이루어지고 있으나, GBM에 대한 천연물 기반 약물 재배치 연구는 많지 않으며, 작용기전이 불분명한 경우가 많다.
이를 보완하기 위해서는 더 많은 기존 약물과 천연물을 발견하고 검증하면서 작용 기전에 대한 명확한 규명을 통해 약물 재배치의 기반이 되는 데이터베이스의 신뢰성을 높이는 것이 필요하며, AI의 오류를 막기 위한 기술적 문제도 해결해야 한다. 또한, BBB에 의한 약물전달의 한계를 극복하고, 해당 종양세포까지 안정적인 약물 전달을 위해 여러 제약업계와 연구자들은 리포좀이나 나노입자, 세포막 코팅, 유사체, 근적외선 활용 등 뇌혈관 장벽을 통과하고, 안정적으로 약물을 종양세포 부위에 특이적으로 전달할 수 있는 약물전달 기술과 전략을 개발하고 확장하는 것이 필요하다(301). 이어질 후속 연구들을 통해 다른 효능으로 알려졌던 일반 약물들과 천연물 기반 약물이 더 많이 재발견되어 교모세포종에 적용될 수 있을 것으로 보인다. 교모세포종에 대한 약물 재배치는 더 안전하고 치료효과가 더 높아질 것으로 기대하는 교모세포종 치료전략으로서, 향후 더 다양한 치료전략을 펼칠 수 있게 하여 환자들과 의료진들에게 여러 선택지를 제공하고, 환자들의 수명 연장과 삶의 질을 보다 더 높일 수 있을 것으로 전망한다.